Artère pulmonaire gauche rétro-trachéale
Définition et épidémiologie
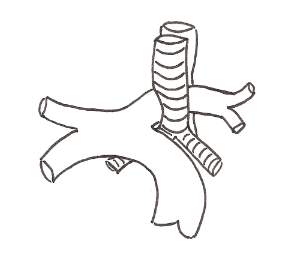
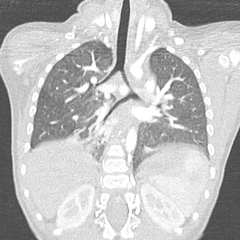
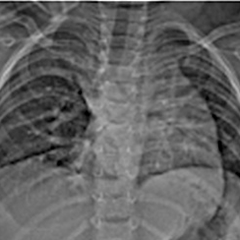
L’artère pulmonaire gauche rétro-trachéale est une malformation rare dans laquelle l’artère pulmonaire gauche nait de l’artère pulmonaire droite et cravate la trachée et passe entre la trachée et l’œsophage pour rejoindre le hile pulmonaire gauche. Dans la majorité des cas, cela entraine une sténose trachéale soit par compression ou par la présence d’anomalie trachéale associée : une trachéomalacie voir des cartilages trachéaux encerclants [2].
L’origine embryologique n’est pas totalement élucidée, l’hypothèse la plus probable est celle d’une agénésie de l’artère pulmonaire gauche avec une suppléance de la vascularisation pulmonaire par l’artère pulmonaire droite, les bourgeons pulmonaires ayant des plexus vasculaires communicants [3].
Il existe une préférence masculine pour cette malformation avec un ratio à 3.
La prévalence est difficile à évaluer étant donné que certains patients sont asymptomatiques, d’autant que la malformation n’est qu’exceptionnellement décelée en échographie anténatale [4].
La malformation est évoquée devant un stridor ou weezing, une détresse respiratoire voir plus tard dans la vie par une dysphagie.
Wells et Landing [5] ont établis une classification en deux types en fonction de la hauteur de la carène et de l’anatomie de l’arbre bronchique :
- Type 1 : carène au niveau des vertèbres T4-T5, respect de l’anatomie trachéobronchique
- Type 2 : carène au niveau de T5-T6, augmentation de l’angle de bifurcation bronchique, et anomalie des angles formés entre l’axe du rachis et les bronches souches.
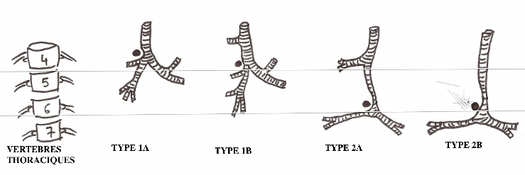
Variantes décrites
30% des sujets atteints présentent des anomalies cardiaques associées.
Dans 25% des cas, on retrouve une veine cave supérieure gauche.
Il existe également fréquemment une CIA, une CIV, voir des cardiopathies plus complexes (Fallot, VDDI).
Les anomalies pulmonaires ne sont pas rares, avec des hypoplasies voir agénésie pulmonaire.
Traitement
Il est uniquement chirurgical.
Dans les cas ou seul la compression vasculaire est responsable d’une sténose trachéale, la technique consiste à réimplanter l’artère pulmonaire gauche sur le tronc de l’artère pulmonaire en avant
de la trachée, sans geste sur l’arbre trachéobronchique.
Dans les cas où il existe une véritable anomalie trachéale (trachéobronchomalacie, cartilages trachéaux encerclants) plusieurs techniques existent : trachéoplastie de glissement, exérèse du
segment sténosé et anastomose terminoterminale, patch ( péricarde ou cartilage costaux) sur le segment sténosé.
Evolution à long terme
90% des patients son symptomatique, 90% dans la première année de vie.
L’évolution naturelle dans ces cas est extrêmement sombre, avec une mortalité à 90% [3].
Le traitement, uniquement chirurgical, n’est pas anodin, et présente un taux de mortalité per et post opératoire non négligeable, notamment en cas d’ anomalie trachéobronchique ou cardiaque
associée.
Apres intervention, l’évolution à long terme dépend de la résolution de la sténose trachéale, la survie moyenne est estimée à 80%. Et des réinterventions sont parfois nécessaires :
trachéostomie, résection de tissu de granulation sur la trachée par bronchoscopie, rarement réintervention chirurgicale.
Le pronostic est meilleur si la réparation de l’anomalie vasculaire et trachéale est effectuée en un temps.
Chez les patients asymptomatiques, le pronostic est excellent et aucune intervention ne sera proposée.
Imagerie
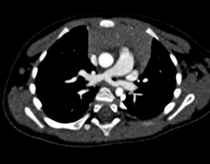
Scanner : pré et post TRT [6,7].
Réalisé avec injection de produit de contraste, environ 20S après le début de l’injection à un débit adapté à la voie veineuse périphérique, on obtient une bonne opacification des artères
pulmonaires.
La synchronisation cardiaque n’est pas nécessaire, ce qui permet une acquisition extrêmement rapide, ce qui est important chez des enfants potentiellement en détresse respiratoire.
Ensuite, on visualise parfaitement l’artère pulmonaire gauche rétro-trachéale, le niveau où elle comprime la trachée et ses mensurations.
Les reconstructions en miniMIP permettent une analyse précise de l’arbre trachéobronchique, de la présence de bronche supérieure droite naissant directement de la trachée et de sténose éventuelle
et la mesure de l’angulation des bronches souches.
La bronchoscopie virtuelle permet une analyse précise du degré et de l’étendue de la sténose trachéale, elle a l’avantage comparativement à une bronchoscopie d’être non invasive et d’étudier
l’arbre bronchique au delà de la sténose. Son seule inconvénient et de ne pas permettre d’analyse dynamique. Il faut s’attacher à ne pas confondre un simple dépôt de mucus avec une sténose.
Les reconstructions en VR peuvent également être utile en préopératoire pour le chirurgien.
Il ne faut pas oublier de détecter une eventuelle anomalie cardiaque associée, bien qu’en pratique ce rôle est laissé à l’échocardiographie.
IRM : pré et post TRT[8,9]
L’IRM est également performant pour le diagnostic de cette anomalie mais ne permet une analyse autant précise que le scanner concernant l’arbre bronchique.
Une simple séquence en T1 axial permet de faire le diagnostique, les séquence d’angio-IRM permettent des reconstructions 3D de l’arbre pulmonaire.
L’analyse des flux au sein des artères pulmonaires peut être réalisé, ce qui peut être utile notamment en post opératoire en cas de sténose anastomotique.
Le principal écueil est le temps d’acquisition plus long que le scanner, qui peut être gênant chez des nourrissons en détresse respiratoire en préopératoire.
Bibliographie
1. Capitanio MA.,
Ramos R.. Pulmonary sling. Am J Roentgen. 1971 ; 112 : 28-34
2. Kastler B, Clair C, Livolsi A, Narboux Y, Delabrousse E, Sarliève P et al.
Malformations des artères pulmonaires. Cardiopathies cyanogènes : aspects IRM.EMC Radiodiagnostic, 2002 ; 32-015-F-70
3. Collins II R.T., Weinberg P.M., Ewing S., Fogel M. Pulmonary Artery Sling in an asymptomatic 15-Year-Old boy. Circulation. 2008 ; 117 : 2403-2406
4. Semple M.G, Bricker L., Shaw B.N.J. Piling D.W. Left pulmonary artery sling presenting as unilateral echogenic lung on 20 weeks detailed antenatal ultrasound examination.
Pediatr Radiol. 2003 ; 33 : 567-569
5. Wells TR, Gwinn JL, Landing BH et al. Reconsideration of the anatomy of sling left pulmonary artery : the association of one form with bridging bronchus and imperforate anus.
Anatomic and diagnostic aspects. J Pediatr Surg .1988 ; 23 :892–898
6. Kagadis G.C., Panagiotopoulo E.C., Priftis K.N., Vaos G, Nikiforidis G.C, Anthracopoulos M.B. Preoperative evaluation of the trachea in a child with pulmonary artery sling using
3-dimensional computed tomographic imaging and virtual bronchoscopy. Journal of Pediatric Surgery 2007 ; 42 : E9-E13
7. Zhong Y.M., Jaffa R.B, Zhu M, Gao W, Sun A-M, Wang Q. CT assessment of tracheobronchial anomaly in left pulmonary artery sling. Pediatr Radiol .2010 ; 40 :
1755-1762
8. Eichhorn J, Fink C., Bock M, Delorme S., Brockmeier K., Ulmer HE. Time-Resolved Three-Dimensional Magnetic Resonance Angiography for Assessing a Pulmonary Artery Sling in a
Pediatric Patient. Circulation. 2002 ; 106 : e61-e62
9. Vogl TJ, Diebold T, Bergman C, Döhlemann C, Mantel K, Felix R, Lissner J.MRI in pre- and postoperative assessment of tracheal stenosis due to pulmonary artery sling. J Comput
Assist Tomogr. 1993 ; 17(6) : 878-86
10. Fiore AC, Brown JW, Weber TR, Turrentine MW.Surgical treatment of pulmonary artery sling and tracheal stenosis. Ann Thorac Surg. 2005 Jan; 79(1):38-46; discussion
38-46.