Embryologie
Rappels Embryologiques Fondamentaux
A la 96° heure, l'embryon parvient dans la cavité utérine au stade de morula.
La morula est un amas de cellules pluripotentes entourée par la zone pellucide.

A ce stade, la migration de l’embryon est terminée. La morula se transforme en blastocyste constitué par une couche de cellules bordant la zone pellucide, le trophoblaste et une zone interne, l'embryoblaste.
A J5, survient le "hatching" : la zone pellucide se rompt et permet ainsi l'implantation de l'œuf dans l'endomètre. Le trophoblaste alors différencié en syncitiotrophoblaste qui envahit l'endomètre et cytotrophoblaste qui borde l'embryon. La circulation placentaire primitive va se mettre en place.
A J8, l'embryoblaste se différencie en épiblaste au niveau dorsal, entourant la cavité amniotique et en hypoblaste, entourant la vésicule vitelline primitive.
Par la suite, sous des phénomènes d'induction apparait la ligne médiane primitive, première ébauche d'une disposition cranio-caudale de l'embryon.
Va alors se produire la gastrulation, qui consiste en une invagination de cellules épiblastiques au sein de la ligne médiane, donnant naissance au mésoblaste. A ce stade, l'épiblaste devient l'ectoblaste, l'hypoblaste devient l'endoblaste.
On passe donc d'un embryon didermique à un embryon tridermique.
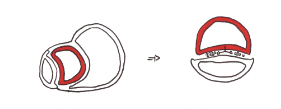
En même temps, on constate la formation de la notochorde par invagination de cellules dans la ligne médiane primitif qui va permettre l'induction de la gouttière neurale, futur tube neural lors de la plicature de l'embryon.
Deux niveaux restent exempts de mésoblaste: la membrane oropharyngée et la membrane cloacale.
Le mésoblaste se situe de chaque coté de la notochorde : il est divisé du plus proche au plus éloigné de la notochorde en mésoblaste para axial, intermédiaire et latéral.
Le mésoblaste para axial se différencie en somitomères au niveau rostral pour donner les arcs branchiaux et en somites à l'origine de la segmentation métamériques.
Le mésoblaste intermédiaire intervient pour former le système urogénital.
Quant au mésoblaste latéral, il borde l'endoblaste du coté ventral de l'embryon et forme avec lui la slanchnopleure (mésoblaste viscéral embryonnaire) qui donnera naissance au tube digestif entre autre. Du coté dorsal, il borde l'ectoblaste pour former le somatopleure (mésoblaste somatique intra embryonnaire) à l'origine des parois.
De la plaque au tube cardiaque primitf
Le cœur est formé à partir du mésoderme splanchnique antérieur (splanchnopleure). Par induction de l'endoderme, on assiste à une différenciation cellulaire et à une migration au pole céphalique de l'embryon pour aboutir à la plaque cardiogénique.
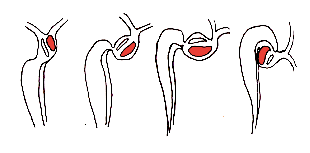
Avant la plicature de 'l’embryon, la plaque cardiogénique a une forme de croissant dont les bords vont se rejoindre lors de la plicature de l'embryon pour former le tube cardiaque primitif.
A ce stade, le tube cardiaque présente un tube endocardique, entouré de gelée cardiaque puis de cellules myocardiques.
L'ébauche péricardique provient du coelome intra embryonnaire et se situe initialement en arrière du tube. Lors de la croissance céphalique, le tube s'invagine dans l'embryon, il subit une rotation de 180° dans le sens cranio caudal et l'ébauche péricardique passe alors en avant de celui-ci.
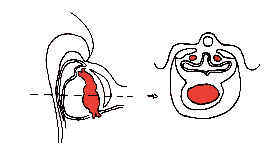
Le tube cardiaque primitif (TCP) est alors constitué:
- de sa voie afférente (veines ombilicales, vitellines et cardinales communes)
- du sinus veineux
- de l'oreillette primitive
- du ventricule primitif
- du conus
- du troncus
- d'une voie efférente constituée par les aortes dorsales.
La circulation est donc sectorielle à ce stade
Par la suite la formation de la boucle bulbo-ventriculaire et la segmentation du cœur aboutissent à une circulation parallèle.
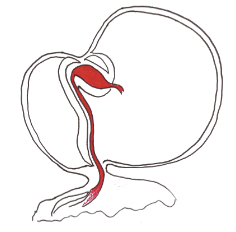
"Looping" bulboventriculaire
Une fois le tube formé, au 23° jour, celui ci va s'infléchir avec une convexité droite. C’est également le début des premiers battements cardiaques.
La voie afférente est repoussée en haut et en arrière du ventricule primitif pour arriver jusqu'au même niveau, à sa droite.
Cette inflexion permet de voir apparaitre une asymétrie gauche-droite ainsi que le sillon bulbo-ventriculaire.
La voie afférente est alors reliée par le sinus veineux à la partie droite de l'oreillette primitive alors que le conotroncus est en relation avec le futur ventricule droit.
A l'intérieur du tube, cette infléchissement fait apparaitre le canal atrioventriculaire.
Le sang afflue de l'oreillette primitive via le canal atrioventriculaire au futur ventricule gauche puis sort du cœur via l'ostium primitif des conus par le futur ventricule droit.
Pour obtenir une cavitation correcte du cœur en quatre, ainsi qu'une circulation parallèle définitive, le cœur va donc devoir subir de nombreux remaniements internes.
Allongement et convergence du tube cardiaque primitif
La convergence a pour but d'aligner dans un plan sagittal le septum interventriculaire, le canal AV et la voie d'éjection constituée par le conotroncus.
Comme nous l'avons vu, à la fin de la plicature du cœur, ces trois structures sont loin d'être dans le même plan.
Un allongement et un déplacement vers la gauche du conotroncus se produit.
Cet allongement se fait via l'apport de cellules issues de l'aire cardiaque antérieure (issue du mésoderme pharyngé antérieur), sous l'action de cellules de la crête neurale migrant jusqu'à celui-ci. Sans cet allongement les remaniements qui suivent sont impossibles.
Simultanément, le canal AV se déplace sur la droite.
Le septum interventriculaire se déplace vers la gauche, via un développement asymétrique des cavités ventriculaires.
Ainsi, ces trois structures sont alignées, étape indispensable à une segmentation correcte des cavités cardiaques.
Les cellules de la crête neurale jouent donc un rôle majeur dans cette convergence et un défaut d'induction de leur part est à l'origine de malformations conotroncales ou de CIV.
Malgré tout, l'ostium primitif du conus est alors dans un plan perpendiculaire au canal AV. Et de plus, l'ostium primitif du conus se situe toujours en regard du futur ventricule droit.
Wedging ou acquisition de la continuité mitro-aortique
Une fois la convergence effectuée, reste à mettre dans le même plan l'ostium primitif du conus avec le canal AV.
Cette étape indispensable, appelé "wedging" par les anglais, permet la continuité mitro-aortique retrouvée dans le cœur définitif.
L'allongement du conus par l'aire cardiaque antérieure est indispensable pour permettre cette " mise au même niveau" des deux structures.
La migration cellulaire à l'origine de l'allongement est controlatérale à la voie d'éjection dans un sens anti horaire.
Cela permet une rotation de l'ostium primitif qui va venir se placer en avant et à gauche du canal AV dans le même plan.
Tout ceci est induit une fois de plus par les cellules de la crête neurale.
En dernier lieu, une fois la rotation effectuée, elles induisent la fusion de la partie postéro-gauche du conus avec la partie antérieure du canal atrioventriculaire. On obtient la continuité nécessaire des deux structures à l'origine de la continuité mitro-aortique.
A partir de maintenant, la segmentation va pouvoir s'effectuer de manière correcte.
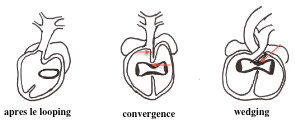
D'une circulation sectorielle à une circulation parallele
Notion de délamination des flux
Dans ce tube cardiaque plicaturé, se trouve une région correspondant au canal atrio- ventriculaire et au canal conotroncal dans laquelle les tissus sont très sensibles à la tension produite par les flux sanguins. La loi de Laplace va ici s’appliquer aux tuyaux et va faire que le tuyau va subir des forces et va réagir à ces forces en fabriquant des crêtes tissulaires : les bourgeons endocardiques. Avant même que le cœur soit formé de ces quatre cavités, il existe déjà deux flux parallèles qui vont participer à la septation correcte des cavités cardiaques.
Notion de zones de transition
Il existe à ce stade quatre zones de transition essentielles qui vont permettre la segmentation du cœur et aboutir au cœur définitif à quatre cavités.
Il s'agit:
- du sinus veineux au contact des veines.
- de l'anneau primitif, repli myocardique entre les deux ventricules
- des bourgeons endocardiques du canal atrioventriculaire: entre le ventricule gauche et l'oreillette primitive
- des bourgeons endocardiques du conotroncus: entre le ventricule droit et le conotroncus.
Les bourgeons endocardiques : après le « looping », la gelée cardiaque va disparaitre sauf au niveau du conotroncus et du canal atrioventriculaire où une migration des cellules endocardiques va se produire, en réponse à des signaux du myocarde, qui vont se transformer en mésenchyme. Ces bourgeons ainsi formés ont trois rôles: diviser le segment d'admission en droite-gauche, former les feuillets valvulaires, induire la muscularisation.
Quant à l'anneau primitif et au sinus veineux, outre leur rôle dans la segmentation cardiaque, ils serviront à la formation du tissu de conduction.
Le sinus veineux
La voie afférente du cœur est constituée par plusieurs réseaux veineux s'abouchant dans le sinus veineux.
Les réseaux veineux embryonnaires:
On distingue:
1) un réseau intra-embryonnaire:
- 2 veines cardinales supérieures et 2 veines cardinales inférieures
- 2 canaux de Cuvier droit et gauche issus de la fusion d'une veine cardinale antérieure et postérieure.
2) deux réseaux extra-embryonnaires:
- 2 veines vitellines droite et gauche
- veines ombilicales ou chorio-allantoidiennes
Tous ces réseaux se drainent par les sinus veineux droit et gauche dans l'oreillette primitive.
La veine cardinale antérieure droite va devenir la veine cave supérieure.
La veine vitelline droite deviendra la veine cave inférieure.
Le sinus veineux gauche et la veine cardinale antérieure gauche donneront le sinus coronaire.
Le reste des veines va involuer totalement, et le sinus veineux droit va s'incorporer dans la paroi postérieure de l'oreillette droite.

Septation auriculaire
On voit apparaitre une expansion au toit de l'oreillette primitive à la droite du sinus veineux, le septum primum, qui se dirige vers le canal AV.
Les bourgeons endocardiques AV vont également participer à la septation auriculaire dans le sens inverse.
Une troisième structure, l'épine vestibulaire, issue du mésocarde dorsal, va recouvrir le bord libre du septum primum. Cela aboutit à la 7° semaine de vie, à la fermeture de l'ostium primum.
En même temps, une vacuolisation du septum primum à sa partie supérieure, va former l'ostium secondum.
A la huitième semaine apparait alors au bord droit du septum primum, le septum secondum, formé de fibres musculaires, issue en partie de l’épine vestibulaire, dérivé du mésocarde dorsal, le développement jusqu’à la jonction atrioventriculaire est incomplet, et forme ainsi l'ostium secondum. Le sang de l’oreillette droite chemine alors au travers de l’ostium secondum puis de l’ostium primum par foramen ovale, pour atteindre l’oreillette gauche. Ce système de circulation est uniquement fœtal et normalement, lors de la naissance, l’augmentation des pressions dans l’oreillette gauche vient plaquer le septum primum contre le septum secondum et fermer le foramen ovale.

Septation ventriculaire
Apres la plicature, il existe un repli myocardique entre les deux ventricules sous forme d'un anneau dans le plan sagittal du cœur.
A partir de l'anneau primitif va se développer le septum interventriculaire musculaire. Celui-ci se déplace progressivement vers la gauche, aidé par la croissance asymétrique des ventricules. En effet, le ventricule droit va connaitre une croissance plus importante que le ventricule gauche grâce à l'adjonction de cellules myocardiques issues de l'aire cardiaque antérieure.
La seconde partie du septum interventriculaire, supérieure, est membraneuse.
Il est issue en partie des bourgeons endocardiques atrioventriculaires et conotroncaux au moment de l'absorption du conus.
Septation conotroncale
Il se produit une élongation de la voie efférente par l’adjonction de cellules de l’aire cardiaque antérieure. L’envahissement par les cellules de la crête neurale qui migrent le long des arcs pharyngés permet ensuite le développement des bourgeons endocardiques. Le conotroncus va alors se cloisonner pour aboutir à la formation de deux gros vaisseaux : l’aorte et le tronc de l’artère pulmonaire. Le cloisonnement se fait en spirale à partir des bourgeons endocardiques du conotroncus. Ceux-ci vont simultanément former les valves semi-lunaires.
Par la suite, la muscularisation, par migration de myocytes au sein de la courbure interne, permet d’aboutir au « wedging » et de placer l’aorte au dessus du ventricule gauche, ainsi que la fusion du septum conal avec le bourgeon antérosupérieur du canal atrioventriculaire.
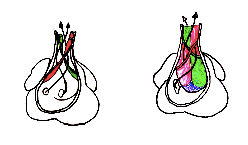
Formation des valves atrioventriculaires
A partir des bourgeons endocardiques, le tissu valvulaire va se développer. Les bourgeons ventral et dorsal vont fusionner et former la valve septale de la tricuspide et la grande valve mitrale. Les bourgeons latéraux participeront à la formation de la petite valve mitrale à gauche et des valves antérieure et postérieure à droite.
Ces bourgeons participent également à la formation du septum interventriculaire membraneux en fusionnant avec le septum interventriculaire musculaire.
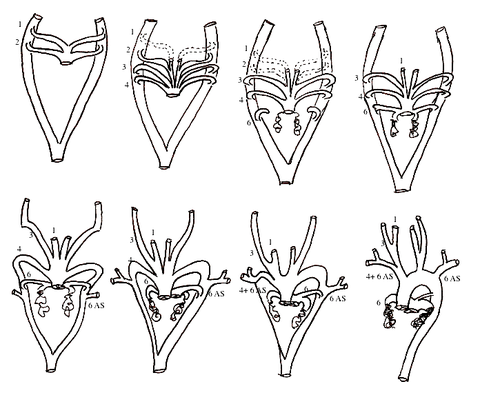
Développement des arcs aortiques
La transformation de ces six paires d’arcs aortiques se déroule entre la 6ème et la 8ème semaines du développement embryonnaire et va aboutir à la configuration définitive de la crosse aortique et de ses branches, telle que nous la connaissons chez l’adulte.
Le premier arc aortique apparait vers le 23ème jour de développement.
Du fait de la migration caudale du sac aortique par rapport à la tête, les arcs aortiques vont se former successivement, caudalement par rapport à la première paire.
Les deux premières paires vont progressivement involuer et se remodeler, formant par la suite une partie des artères carotides externes.
La troisième paire d’arcs aortiques va avoir une évolution plus importante, pour devenir pour sa partie proximale l’artère carotide commune de chaque côté, et pour sa partie distale les artères carotides internes par continuité avec les aortes dorsales paires.
Le 4ème arc aortique gauche formera la majeure partie de la crosse aortique
Le 4ème arc aortique droit formera la partie proximale de l’artère sous-clavière droite, sa partie distale résultant du remodelage de l’aorte dorsale droite et de la sixième artère intersegmentaire cervicale droite.
L’artère sous-clavière gauche est quant à elle entièrement dérivée de la 6ème artère inter-segmentaire cervicale gauche.
A droite, la partie proximale du 6ème arc aortique donne naissance à la partie proximale de l’artère pulmonaire tandis que sa partie distale dégénère.
Le 6ème arc aortique gauche va donner pour sa partie proximale l’artère pulmonaire gauche et pour sa partie distale le canal artériel qui assure au cours de la vie utérine une communication entre le dôme de l’artère pulmonaire et la crosse aortique.
La configuration quasi-définitive de la crosse résulte de la séparation de l’aorte dorsale entre le 4ème arc et la région de fusion des aortes dorsales, consécutive à une oblitération de ce segment, duquel ne subsistera qu’une petite partie formant l’artère sous-clavière droite avec le 4ème arc aortique et la 6ème artère inter segmentaire.
Bibliographie
- Jouannic JM., Bonnet D. Le cœur fœtal. Edition Sauramps médical. 2011.
- Houyel L. Embryologie du cœur normal. EMC Cardiologie.
- www.embryology.ch. Chapitre organogénèse du système cardiovasculaire.
Jimdo c'est une creation site internet très facile !