Imagerie par résonance magnétique
Conditions préalables
L'antenne
L’antenne de surface utilisée doit être dans la mesure du possible adaptée à celle du thorax.
Chez le tout petit, de moins de 7 kilos, une antenne tête peut suffire, voire une antenne genou.
Il existe des antennes spécifiques pour la population pédiatrique mais dans tous les cas, il faut utiliser une antenne de surface dédiée en réseaux phasés. (Antenne cœur ou torso ou corps selon la taille du patient) à haute densité d’éléments pour augmenter le rapport signal sur bruit.
Mise en place
Patient en décubitus dorsal.
Les pieds en premier dans l'anneau.
La sedation et la contention
Chez le nouveau-né, aucune sédation n’est nécessaire. Un biberon avant l’examen suffit ainsi qu’une contention adaptée.
Chez le nourrisson avant 6 mois, avec une hémodynamique stable, la sédation n’est pas nécessaire, seule une contention adaptée suffit.
Chez le nourrisson après 6 mois (et jusqu'à 6 ans) ou avec une hémodynamique instable, une équipe anesthésique doit être présente pour la sédation et une surveillance rapprochée pendant l’examen.
Lors de la sédation, un monitorage précis de la fréquence cardiaque, de la saturation et du CO2 expiré doit être permis. De plus, une attention particulière doit être portée à la température, car il existe un risque réel d’hypothermie.
La ventilation artificielle a l’avantage de permettre la réalisation d’apnée au cours de l’examen, mais cela rend l’examen plus invasif. Le plus souvent, la sédation se fait par des gaz fluorés en ventilation spontanée.
Une estimation du rapport bénéfice/risque guide toujours le choix de la méthode employée.
Synchronisation ECG
La synchronisation cardiaque est indispensable sauf pour les séquences de repérage.
Des électrodes sont donc posées sur la face antérieure du thorax.
Le choix de la meilleure dérivation (qui fournit la plus grande onde R) sera retenu pour permettre une identification correcte de l’espace RR.
La synchronisation peut être prospective ou rétrospective.
- · de manière prospective sur une partie du cycle cardiaque : déclenchement de l’acquisition sur l’onde R et départ immédiat sur une fenêtre inférieure au RR

- de manière rétrospective sur toute la durée du cycle cardiaque : acquisition continue du signal sur tout l’espace RR. Les signaux sont ensuite redistribués dans l’espace de Fourier selon leur position temporelle dans le RR.

Apnée et synchronisation respiratoire
Surtout indispensable pour la caractérisation des flux et l’étude tissulaire par les séquences « sang noir » (voir ci-dessous).
La synchronisation respiratoire peut s’effectuer à partir d’une sangle abdominale qui détecte les mouvements respiratoires, acquisition des données en fonction du cycle respiratoire (même principe que la synchronisation ECG).
Il est possible mais difficile d'associer les deux gating (cardiaque et respiratoire) en même temps.

Produitde contraste
Gadolinium à la dose de 0,2-0,3 mmol/ Kg ou 0,4 ml/Kg injecté manuellement chez le nourrisson puis à l’injecteur automatique en environ une dizaine de secondes suivi d’un lavage par l’injection d’un volume identique de sérum physiologique.
Séquences utilisées
Réglages des séquences spécifiques à la pédiatrie
Petites structures donc besoin d’une très bonne résolution spatiale et nécessité de diminuer le temps d’acquisition et donc d’avoir une bonne résolution temporelle :
- 1)Augmenter la résolution spatiale
- - le champ de vue : petit (20-26 cm)
- - l’épaisseur des coupe : fines (3-5mm)
- - espacement des coupes tous les 0,3 à 0,5 mm (10% de l’épaisseur de coupes)
- 2)Augmenter le rapport signal/bruit :
- - diminution de la matrice [3]
- 3)Diminuer le flou cinétique :
- - augmentation du nombre d’excitations : moyennage de signaux multiples réduire le nombre de vue acquise par segments
- - minimiser les temps de répétition (TR) durant chaque cycle cardiaque
- - technique de moyennage et d’échonavigateur pour diminuer les artéfacts respiratoires quand l’apnée n’est pas réalisable.
Séquences morphologiques
Echo de spin conventionnel T1 ou fast-spin-écho en inversion-récupération (IR-FSE) dites « sang noir ». Le sang apparaît noir et les tissus gris.
Nécessite une synchronisation cardiaque et une apnée.
Déclenchement différé de l’acquisition sur l’onde R.
La séquence est donc acquise en monophase, au moment de la télédiastole. Ces séquences permettent une résolution spatiale très performante, avec une analyse fine des vaisseaux et de leurs parois.

Ces séquences sont utiles car permettent de s’affranchir des artefacts métalliques liés à la présence de stents, coils, fils de sternotomie ou autres objet métalliques en post-opératoire.
Elles sont également utiles pour analyser les voies aériennes, ainsi que pour une caractérisation tissulaire (tumeur ou dysplasie arythmogène du ventricule droit par exemple)
Ces séquences sont longues et ne permettent par contre aucune analyse dynamique.

Séquences cinétiques
Séquences rapides type Echo de gradient :
- avec suppression de l’aimantation transversale résiduelle (Flash, FFE T1, SPGR)
- sans suppression de l’aimantation résiduelle transversale, écho stimulé, type Steady State Free Précession (True FISP, Fiesta, BFFE)
Séquences dites « sang blanc ». Le sang apparaît blanc et les tissus gris.
Nécessite une synchronisation cardiaque et apnée nécessaire.
La séquence est acquise en multiphase de manière prospective ou rétrospective. Cela permet une analyse dynamique des mouvements cardiaques.
On mesure ainsi les volumes ventriculaires télé-systolique et télé-diastoliques, soit de manière manuelle, soit, plus souvent, de manière semi-automatique grâce à des logiciels de post traitement qui contourent les cavités cardiaques en télé-diastole et en télé-systole, permettant ainsi la mesure de la fraction d’éjection.
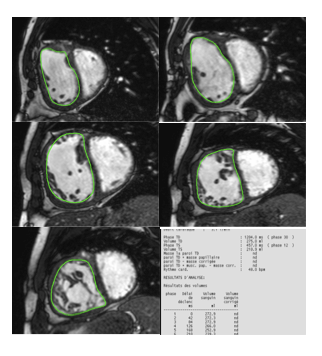
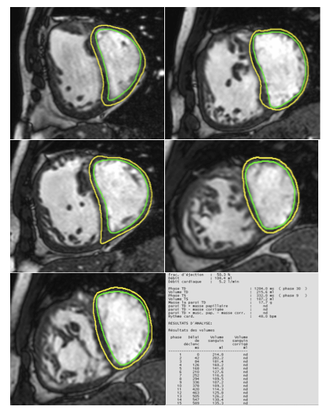
La visualisation d’un vide de signal au sain du pool sanguin indique une accélération du flux, qui permet de détecter des sténoses, régurgitations trans-valvulaires ou communications inter-auriculaires ou ventriculaires. C’est une analyse qualitative des flux. Par la suite les séquences en codage de phase (ci-dessous) permettent une analyse quantitative.

Séquences de quantification des flux
Séquence d’écho de gradient avec codage de flux en contraste de phase.
Synchronisation cardiaque avec apnée recommandée.
Résolution temporelle jusqu’à 30 phases par cycle cardiaque et par apnée pour une coupe.
Le flux est codé en blanc lorsqu’il va vers le lecteur et en noir lorsqu’il s’éloigne.
Pour mesurer une vitesse de flux, le plan de la coupe doit être parfaitement perpendiculaire à l’axe du vaisseau exploré et les vitesses d’encodage adaptée.
Une vitesse d’encodage trop faible entraine des artefacts de repliements, comme l’effet d’aliasing en écho-Doppler, et amène à des mesures de flux erronées.
Une fois la coupe obtenue, le contourage du vaisseau permet une mesure de sa surface.
Le flux est calculé en multipliant la vitesse par la surface.
On obtient une courbe dans un plan orthogonal avec en abscisse le moment du cycle cardiaque et en ordonné les vitesses du flux.
Grace à ces mesures de flux, on peut ainsi déterminer :
- le rapport Qp/Qs en mesurant les vitesses au sein de l’aorte ascendante et du tronc de l’artère pulmonaire (utile en cas de shunt gauche-droit par exemple)
- les gradients de pressions trans-valvulaires en cas de sténose, en utilisant l’équation de Bernoulli
- les fractions de régurgitations trans-valvulaires mitrale ou tricuspide en corrélation avec les mesures des fractions d’éjection ventriculaire[].
Séquences d'angiographie: sans ou avec injection de produit de contraste
Séquences 3D SSFP avec synchronisation cardiaque et apnée ou séquence d’écho de gradient rapide T1 d’angiographie après injection de gadolinium.
Permet d’avoir des voxels isotropiques et donc des reconstructions en MPR, VR ou MIP et une analyse morphologique des structures extra-cardiaques extrêmement précise.
Le moment de l’acquisition en cas d’injection de gadolinium est au mieux effectué grâce à des techniques de détection automatique (smart prep) ou de fluoro-MR.

Séquences de perfusion
Séquence en écho de gradient ultra-rapide avec un TE et TR Court et un petit angle de bascule;(SR-SE-EPI /turbo flash 3D) La pondération T1 est obtenue par une bascule non sélective de 180° précédent l’acquisition.
Permet une étude dynamique de la prise de contraste du myocarde.
Peut être intéressant en cas de contrôle post-opératoire d’une transposition des gros vaisseaux pour évaluer des zones d’ischémie myocardique par exemple ou des zones d’hyperhémie en cas de myocardites.
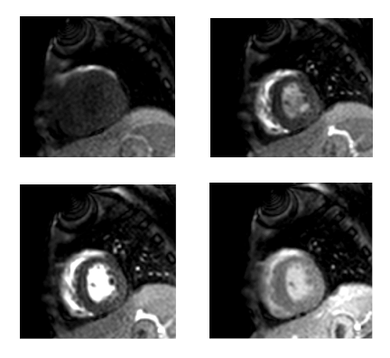
Séquences de rehaussement tardif
Séquences 2D ou 3D écho de gradient T1 d’inversion récupération avec annulation du signal du myocarde sain ayant pour but d’optimiser le différentiel myocarde sain/myocarde nécrosé. Pour obtenir la meilleure annulation du signal du myocarde sain, on utilise la technique du « TI scouting », ou l’on choisit le meilleur temps d’inversion avant de réaliser l’acquisition.
Séquences de coro-IRM
Séquences 3D sans injection de gadolinium
Permet surtout d’analyser l’origine et le trajet initial des coronaires, mais pas leur trajet distal.
Plans de coupe
Images localisatrices: 3 plans orthogonaux
Echo de gradient rapide ou SFFP avec synchronisation cardiaque et en apnée sur l’ensemble du thorax.
Ces séquences servent juste de repérage pour obtenir des plans de coupes adaptés.

Grand axe VG
A partir des coupes axiales localisatrices, on choisit un plan de coupe passant par l’apex puis le milieu de la valve mitrale et la paroi postérieure de l’oreillette gauche. On obtient ainsi une vue sagittale oblique dans le grand axe du ventricule gauche.

Petit axe VG
A partir des coupes grand axe du VG, on choisit un plan de coupe perpendiculaire au grand axe du VG. On obtient ainsi des coupes petit axe qui vont servir de repère pour avoir des coupes quatre cavités.

4 cavités
A partir des coupes grand axe et petit axe du VG, on choisit un plan de coupe passant par le grand axe du VG sur les coupes grand axe du VG et un plan axial oblique passant par la partie la plus large de la cavité ventriculaire droite et entre les piliers mitraux sur la coupe petit axe. On obtient ainsi une coupe 4 cavités en double obliquité.

VD grand axe
A partir d’une coupe quatre cavités et petit axe, on choisit un plan de coupe passant par le grand axe du VD.

Voie de sortie droite
A partir d’une coupe coronale, on choisit un plan de coupe quasi sagittal dans le plan de la voie de sortie droite.

Petit axe vrai
A partir des coupes grand axe du VG et quatre cavités, on choisit un plan perpendiculaire au grand axe du VG, on obtient un coupe petit axe sur lequel sera mesuré les volumes ventriculaires.

Chambre de chasse du ventricule gauche ou 3 cavités
A partir des coupes axiales au niveau de la valve aortique et petit axe, on choisit un plan de coupe passant par la valve aortique et entre les piliers mitraux pour obtenir sur une même coupe le chambre de chasse du VG et la visualisation de la jonction aurico-ventriculaire gauche.

Chambre de chasse du ventricule gauche ou coronal oblique
A partir de la coupe 3 cavités, on choisit un axe passant par la voie d’éjection du ventricule gauche, on obtient une coupe quasi-coronale passant par la chambre de chasse du VG. Pour gagner du temps (et des apnées et donc diminuer la fatigue de l'enfant), on peut directement choisir le plan coronal strict qui passe par le centre de la valve aortique repéré sur une coupe axiale stricte.

Axiale oblique centrée sur la valve aortique
A partir de la coupe coronale oblique sur la voie de sortie gauche, on choisit un plan de coupe dans le plan de la valve aortique, on obtient une coupe quasi-axiale permettant l’analyse de la valve aortique.

Sagittale oblique déroulant l’aorte thoracique
A partir d’une coupe axiale, on choisit un plan de coupe passant par l’aorte ascendante et descendante, en sagittal oblique.

Bibliographie
- Viallon M, Croisille P. Imagerie par résonance magnétique cardiaque : aspects techniques et réalisation pratique (1) . EMC Radiodiagnostic cœur poumon. [ 32-005-A-10]
- Viallon M, Croisille P. Imagerie par résonance magnétique cardiaque : aspects techniques et réalisation pratique (2) . EMC Radiodiagnostic cœur poumon. [ 32-005-A-11]
- Kellenberger CJ, Yoo SJ, Valsangiacomo Buchel ER Cardiovascular MR Imaging in Neonates and Infants with Congenital Heart Disease. Radiographics. 2007; 27:5–18
- Chung T. Assessment of Cardiovascular Anatomy in Patients with Congenital Heart Disease by Magnetic Resonance Imaging Pediatr Cardiol 2000 ; 21:18–26
- Kastler B, Livolsi A, Germain P,Rodière E, Litzler JF, Bernard Y. IRM des cardiopathies congénitales. EMC Cardiologie 2005 [11-940-A-85]
- Ntsinjana HN, Hughes ML, Taylor AM The Role of Cardiovascular Magnetic Resonance in Pediatric Congenital Heart Disease. Journal of Cardiovascular Magnetic Resonance 2011, 13:51