Atrésie pulmonaire à septum ouvert
Définition et épidémiologie
L’atrésie pulmonaire à septum ouvert (APSO) est définie par une absence de communication entre le ventricule droit et le tronc de l’artère pulmonaire associé à une communication interventriculaire membraneuse.
Il s’agit d’une entité rare, puisqu’elle ne représente que 2% des cardiopathies congénitales.
Dans 30% des cas, une anomalie génétique est retrouvée, notamment une délétion 22q11, étant donné qu’il s’agit d’une anomalie conotroncale.
Embryologie
Il existe un continuum entre la tétralogie de Fallot et l’APSO, en effet l’anomalie princeps est la même, un défaut d’alignement du septum conal. Ce malalignement est responsable de la CIV ainsi que de la sténose sur la voie pulmonaire. Dans le cas de l’APSO, le malalignement est tel qu’il entraine une obstruction complète de la voie pulmonaire, donc une atrésie.
Description anatomique et variantes décrites
L’APSO constitue un spectre étendu d’anomalie.
Dans tous les cas, il existe un défaut de connexion entre le ventricule droit et le tronc de l’artère pulmonaire.
Le flux sanguin pulmonaire doit donc être assuré par une autre origine que le tronc de l'artère pulmonaire et le VD, et on distingue différentes sources :
- le canal artériel
- les collatérales systémico-pulmonaires :
- Les collatérales aorto-pulmonaires directes : MAPCA (Major Aorto-Pulmonary Collaterals Arteries) : reliquat embryologique, il s’agit d’artères naissant de l’aorte et vascularisant le poumon, s’anastomosant soit au niveau hilaire ou en intralobaire avec les artères pulmonaires.
- Les collatérales aorto-pulmonaires indirectes : naissent de l’artère sous-clavière ou du tronc artériel brachio-céphalique
- Les collatérales bronchiques, pariéto-pleurales, coronaires.
En effet, selon la perméabilité du canal artériel, un réseau de collatérales systémico-pulmonaires va se développer pour assurer un débit sanguin pulmonaire suffisant.
Une classification permet de déterminer le type de l’APSO et d’adapter la prise en charge chirurgicale.
Classification Marciano et B
Clinique
Les signes cliniques principaux sont : l’hypoxie et la cyanose.
Leur intensité dépend essentiellement de la présence ou non du canal artériel ou de MAPCA.
Traitement
La prise en charge chirurgicale est autant variée que les types d’APSO. Elle dépend essentiellement de l’anatomie des artères pulmonaires principales, de leur confluence ou non et surtout de la présence ou non de collatérales systémico-pulmonaires.
Les techniques utilisées sont :
- Shunt type Blalock-Taussing (mise en place d’un tube en Dacron entre l’artère sous-clavière droite le plus souvent et l’artère pulmonaire droite) pour augmenter le flux sanguin et permettent le développement des artères pulmonaires.
- Reconstruction de la voie pulmonaire, soit directement par un patch péricardique soit à l’aide d’un tube entre l’artère pulmonaire et le ventricule droit.
- Unifocalisation , les collatérales systémiques vont alors être réimplantées une à une sur l’arbre pulmonaire.
- La fermeture de la CIV constitue le dernier geste effectué, lors d’une chirurgie ultérieure, cela permet de ne pas augmenter de manière massive et brutale la charge de travail du ventricule droit.
Imagerie
Préopératoire
Tant le scanner que l'IRM permettent un diagnostic précis de l'anatomie des artères pulmonaires, ainsi que des eventuelles voies de dérivation, indispensable à décrire pour le chirurgien.
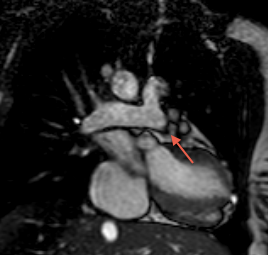
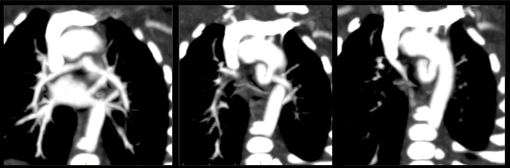
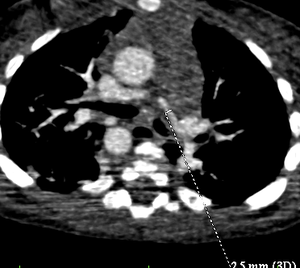
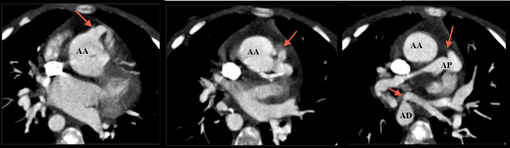
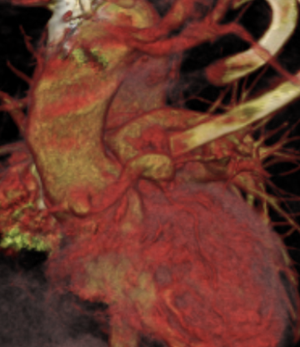
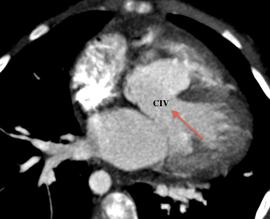
Postopératoire
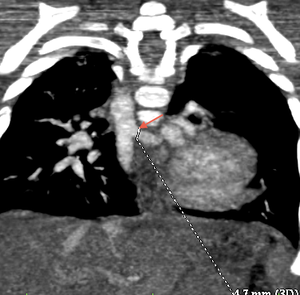
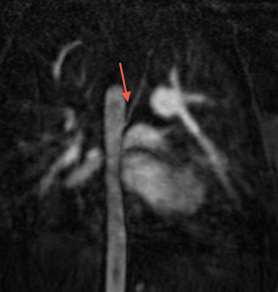
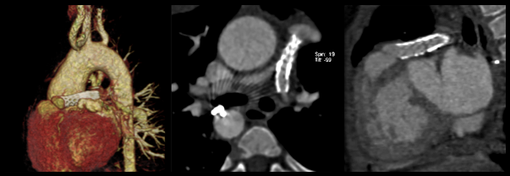
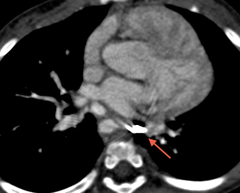
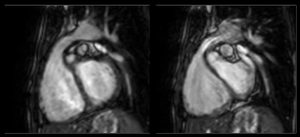
Le scanner ou l'IRM ont également une place importante dans l'analyse des artères pulmonaires, leur taille et leur morphologie. L'analyse des anastomoses doivent également etre analysées et décrites.
Il ne faut pas non plus négliger l'analyse de l'aorte qui peut etre dilatée.
Bibliographie
- Lofland GK. Reprint of One-Stage Repair and Unifocalization for Pulmonary Atresia with Ventricular Septal Defect and Major Aortopulmonary Collateral Arteries in Early Infancy.Progress in Pediatric Cardiology 2009 ; 26 : 97–108
- Srivinas B, Patnaik AN, Rao DS.Gadolinium-Enhanced Three-Dimensional Magnetic Resonance Angiographic Assessment of the Pulmonary Artery Anatomy in Cyanotic Congenital Heart Disease With Pulmonary Stenosis or Atresia: Comparison With Cineangiography Pediatr Cardiol 2011 ; 32:737–742
- Boechat MI, Ratib O, Williams PL, Gomes AS, Child JS, Allada V.Cardiac Magnetic imaging and MR angiography for assessment of complex tetralogy of Fallot with pulmonary atresia. Radiographics 2005 Nov-Dec; 25(6): 1535-46
- Anwar S, Qureshi AM, Arruda J, Bolen MA.Pulmonary atresia with aortopulmonary and coronary artery collaterals: precise depiction by low-dose computed tomography. J Am Coll Cardiol 2012 Jan 3;59(1):90
- Rajeshkannan R, Moorthy S, Sreekumar KP, Ramachandran PV, Kumar RK, Remadevi KS. Role of 64-MDCT in evaluation of pulmonary atresia with ventricular septal defect.AJR Am J Roentgenol 2010 Jan; 194(1): 110-8
- Reddy VM, McElhinney DB, Amin Z, Moore P, Parry AJ, Teitel DF, Hanley FL. Early and intermediate outcomes after repair of pulmonary atresia with ventricular septal defect and major aortopulmonary collateral arteries: experience with 85 patients. Circulation.2000 Apr 18; 101(15): 1826-32
- Macé L, Dervanian P, Neveux JY. Atrésie pulmonaire à septum ouvert. EMC techniques chirurgicales-Thorax 1997 [42-816]
- Amark KM, Karamlou T, O'Carroll A, MacDonald C, Freedom RM, Yoo SJ, Williams WG, Van Arsdell GS, Caldarone CA, McCrindle BW.Independant risk factors associated with mortality reintervention and achievement of complete repair in children with pulmonary atresia with ventricular septal defect.J Am Coll Cardiol 2006 Apr 4; 47(7): 1448-56
- Barbero-Marcial M. Classification of pulmonary atresia with ventricular septal defect.Ann Thorac Surg 2001 Jul; 72(1):316-7