Anomalies des retours veineux pulmonaires
Définition et épidémiologie
Cette anomalie rare, est retrouvée dans 0,6% des autopsies pour sa forme partielle, jusqu’à 7% dans les cardiopathies congénitales. La forme dite « totale » ne représente que 2% des cardiopathies congénitales[1] et 7 sur 100 000 naissances avec une prépondérance masculine (Sex ratio 3/1).
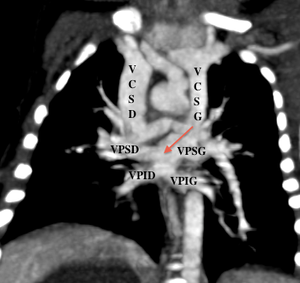
On parle de retour veineux pulmonaire anormal (RVPA) lorsqu’une ou plusieurs veines pulmonaires ne s’abouchent pas dans la paroi postérieure de l’oreillette gauche. Ainsi la ou les veines de drainage anormal vont s’aboucher dans le système cave voire le système azygos ou porte, ou directement dans l’oreillette droite.
Embryologie
Ces anomalies résultent d’une erreur lors de l’embryogenèse. Les veines pulmonaires sont initialement développées au sein des bourgeons pulmonaires ; par la suite elles confluent vers la veine pulmonaire primitive qui viendra s’aboucher dans la paroi postérieure de l’oreillette gauche et finira par s’incorporer à celle-ci en constituant sa paroi postérieure. On comprend que selon le stade ou l’incorporation ne s’est pas faite, on observe soit une anomalie dite partielle (une partie seulement des veines pulmonaires ne s’abouchent pas dans l’OG) ou une anomalie totale (aucune veine ne s’abouche dans l’OG) avec présence d’un collecteur (qui correspond en fait à la veine pulmonaire primitive)[2].
Anatomie descriptive et variantes
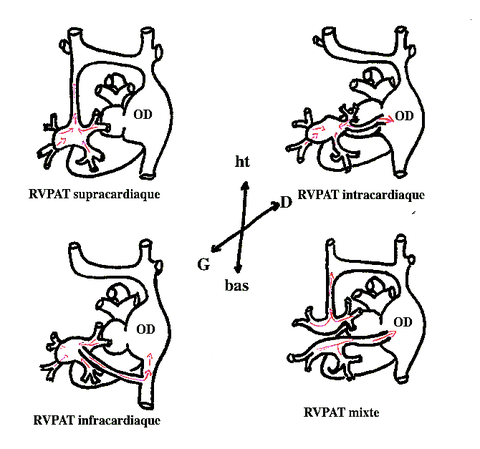
On distingue donc :
- les retours veineux anormaux totaux (RVPAT) (30%) dont :
- supra-cardiaques (50%)
- cardiaques (20%)
- infra-cardiaques (25%)
- mixtes (5%)
On parle de RVPAT bloqué lorsqu’il existe une sténose au niveau du collecteur.
- les retours veineux anormaux partiels (70%)
- droit (70%)
- gauche (30%)
Avec toujours la même dénomination en fonction de la localisation du drainage anormal : supra-cardiaque, cardiaque, infra-cardiaque.
Un type particulier est la cœur triatrial ou cortriatrium sinister qui correspond à l’abouchement des 4 veines pulmonaires dans une cavité postérieure à l’OG, séparé de celle-ci par une fine membrane.[3]
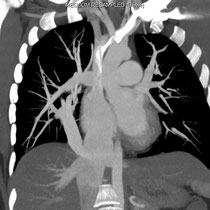
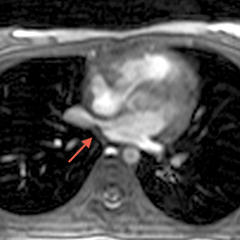
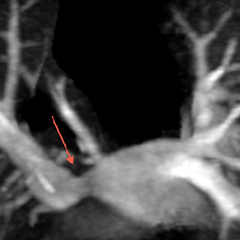
Le syndrome du cimeterre est le terme classique employé pour un RVPAP droit infra-cardiaque où, sur la radiographie standard, le collecteur donne un aspect de sabre au sein du parenchyme pulmonaire droit.[1] Les séquestrations pulmonaires sont également classiques dans ce syndrome.
Dans 70% des cas de RVPA, il s’ associe une CIA.[2]
Clinique
Retour veineux pulmonaire anormaux totaux
L’histoire naturelle est sombre, avec une mortalité élevée.
Le tableau clinique bruyant, en cas de forme bloquée, par une détresse respiratoire néonatale, cyanose et défaillance cardiaque.
En cas de forme non bloquée, apparaissent plus progressivement des signes d’insuffisance cardiaque, une cyanose modérée et un retard staturo-pondéral.
Retours veineux pulmonaires anormaux partiels
Le diagnostic n’est pas forcement effectué en période néonatale ou dans la petite enfance ; on constate alors comme principaux signes une dyspnée et une fatigabilité à l’effort, ainsi que la présence de troubles du rythme supra-ventriculaires, à l’extrême on observe une défaillance cardiaque droite avec une maladie vasculaire pulmonaire en rapport avec le shunt gauche-droit.
Exemple d'un cimeterre
Traitement
Retour veineux pulmonaire anormal total
Dans le cas des formes dites « bloquées », il s’agit d’une urgence néonatale. Dans les autres cas, le traitement est différé, réalisé dans les premiers mois de vie.
L’abouchement des veines dans le collecteur veineux, qu’il soit supra ou infra cardiaque se situe toujours en arrière de l’oreillette gauche. Le geste chirurgical consistera donc à inciser de manière transversal (essentiellement en cas de RVPAT supra-cardiaque) ou vertical (RVPAT infra-cardiaque) le collecteur au niveau où les veines s’abouchent. Parallèlement, une incision de la paroi postérieure de l’oreillette gauche est effectuée, en miroir de celle réalisé sur le collecteur. Puis une suture bord à bord des deux incisions en miroir permet de rétablir un drainage normal, dans l’oreillette gauche, des veines pulmonaires.
Selon les équipes et la présentation clinique du nourrisson, le collecteur est ligaturé ou laissé perméable, ce qui permet d’éviter une augmentation brutale des pressions au sein des cavités gauche qui sont, initialement, peu compliantes. Dans d’autres cas, une incision longitudinale du collecteur permet une plastie d’agrandissement de l’oreillette gauche.[7]
Retour veineux pulmonaire anormal partiel
A droite : technique de tunnelisation de la ou des veines pulmonaires anormales par un patch de péricarde vers l’oreillette gauche au travers de la CIA si elle existe ou par septotomie inter-auriculaire et tunnelisation si le septum est intact. Pour éviter que la tunnelisation ne gène le retour veineux cave, des techniques soit de plastie auriculaire droite d’agrandissement soit de translation de l’abouchement cave supérieure sur l’auricule droit sont effectuées.[8]
A gauche : la veine pulmonaire est anastomosée, après incision au niveau de son abouchement dans le TVI, avec l’auricule gauche.
Evolution à long terme
Retour veineux pulmonaire anormaux totaux
L’avènement de la chirurgie a considérablement modifié la survie de ces patients. Le taux de survie est estimé à 56% à 14 ans, sur une étude comprise entre 1946 et 2005[5]. Le taux de survie a fortement augmenté dans les dernières années, en raison d’une meilleure approche chirurgicale et de réanimation, avec aujourd’hui un taux de survie de 97% à 5 ans. Les facteurs de risque de mortalité post-opératoire identifiés sont l’utilisation d’une hypothermie profonde avec cardioplégie, l’opération réalisée en période néonatale, le type « cardiaque » de connexion, la présence d’une sténose du collecteur.[4]
La présence d’une sténose est également corrélée au risque de réintervention, qui est actuellement de 10%.[5]
Des symptômes cardiovasculaires sont présents chez environ 10% des cas en post-opératoire.[5]
Retours veineux pulmonaires anormaux partiels
La survie après chirurgie s’est nettement améliorée ces dernières années et la morbi-mortalité de nos jours est quasi-nulle. Les patients présentent alors une qualité de vie très satisfaisante. Le risque de troubles de la conduction après intervention est également du domaine du passé. Un risque de sténose post-opératoire au niveau de la veine pulmonaire mais aussi au niveau de la veine cave supérieure et d’hypoperfusion pulmonaire reste le principal problème post-opératoire [6].
Néanmoins, tous les patients ne sont pas opérés, seul ceux présentant un shunt significatif subissent une intervention.
Imagerie
Que ce soit l’IRM ou le scanner, les deux techniques sont hautement performantes pour déterminer la présence d’un RVPA et décrire avec précision son anatomie. Ces examens étant nettement supérieurs à l’échographie en terme diagnostique. [9,10,11,12]
Dans un souci de radioprotection chez des patients qui seront suivis régulièrement en imagerie en coupes, l’IRM sera préférée dès que l’âge et/ou la coopération de l’enfant le permettent[12].
En pré-opératoire
L’imagerie en coupes est surtout réalisée dans le cadre des RVPA partiels, permettant de déterminer avec exactitude le type et l’abouchement du collecteur veineux. De plus, ce type d’examen est souvent réalisé chez de grands enfants ou jeunes adultes et non en période néonatale, ce qui rend l’examen de meilleure qualité.
Exceptionnellement et si l’état clinique le permet, le scanner préopératoire de RVPAT néonatal peut être intéressant pour déterminer le drainage exacte du collecteur, surtout en cas de forme infra-cardiaque, ou pour préciser l’anatomie exacte d’un type mixte.[9]
Il est important de ne pas méconnaitre une CIA et d’en préciser le type. Elle sera détectée au mieux sur les coupes quatre cavités et en mode ciné par la visualisation du jet de shunt en IRM. Il est également important en IRM de mesurer le rapport Qp/Qs pour évaluer le degré du shunt gauche-droit.[13]
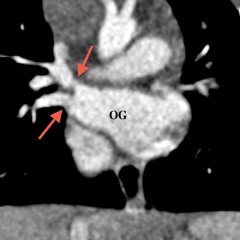
En IRM, les coupes axiales permettent de voir l’absence d’une ou de plusieurs veines se drainant dans l’OG ; les coupes coronales seront utiles pour décrire le trajet du collecteur et son abouchement.[1]
Sur les séquences d’angio-IRM ou d’angio-TDM, la recherche d’une séquestration pulmonaire, surtout en cas d’anomalie du RVPAP de type cimeterre, est importante.
Le cortriatrium sinister sera également diagnostiqué en visualisant une membrane scindant l’OG avec la partie postérieure recevant les 4 veines pulmonaires.
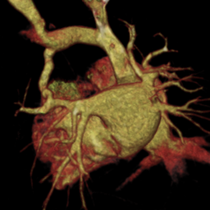
GALERIE D'IMAGES:
Reconstruction VR: Aspect de RVPAP supracardiaque de la VPSG et collecteur dans le TVI
En post-opératoire
L’imagerie en coupes est très utile pour détecter une sténose sur les veines pulmonaires.
L’ IRM est l’examen de choix, permettant de détecter sur les simples séquences morphologiques, en écho de gradient, une éventuelle sténose, voir d’en analyser le flux.
Des séquences en mode ciné oblique sur le trajet de la veine sténosée permettent une analyse précise de celle-ci et éventuellement de voir un jet turbulent[11]
Les séquences d’angio-IRM peuvent également visualiser une hypoperfusion pulmonaire ipsilatérale à la sténose pulmonaire post-opératoire.
Le scanner est également capable de déterminer la présence de sténoses post-opératoires mais ne permet pas d’analyse fonctionnelle.
Bibliographie
- Kastler B, Clair C, Delabrousse E, Klinkert, A,Livolsi A, Sarlieve P, Allal R, Vetter D, Germain P, Bernard Y. Retour veineux systémiques et pulmonaires anormaux : aspect IRM et classification. EMC Radiodiagnostic.2002 ; 32-016-A-20
- Dillman JR., Yarram SG., Hernandez RJ. Imaging of Pulmonary Venous Developmental Anomalies AJR 2009; 192:1272–1285
- Bassil R., Plat G., Marcoux M-O., Zabalawi A., Lelong-Tissier M-C., Daussac E., Taktak A., Dulac Y., Acar P.Cœur triatrial gauche : une cause inhabituelle de détresse respiratoire néonatale. Archives de Pédiatrie. 2006 ; 13 : 1129-1131
- Karamlou T., Gurofsky R., Al Sukhni E., Coles JG., Williams WG., Caldarone CA., Van Arsdell GS., McCrindle BW. Factors Associated With Mortality and Reoperation in 377 Children With Total Anomalous Pulmonary Venous Connection. Circulation. 2007; 115:1591-1598
- Kelle AM., Backer CL., Gossett JG., Kaushal S., Mavroudis C. Total anomalous pulmonary venous connection: Results of surgical repair of 100 patients at a single institution. J Thorac Cardiovasc Surg 2010; 139:1387-94
- Alsoufi B., Cai S., Van Arsdell GS., Williams WG., Caldarone CA., Coles JG. Outcomes After Surgical Treatment of Children With Partial Anomalous Pulmonary Venous Connection.Ann Thorac Surg 2007; 84:2020–6
- Kanter KR.. Surgical Repair of Total Anomalous Pulmonary Venous Connection Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann 2006 ; 9:40-44
- Said SM, Burkhart HM, Dearani JA, Eidem B, Stensrud P, Phillips SD, Schaff HV. Outcome of Caval Division Techniques for Partial Anomalous Pulmonary Venous Connections to the Superior Vena Cava. Ann Thorac Surg 2011;92:980–5
-
-
-
- Vyas HV, Greenberg SB, Krishnamurthy R. MR imaging and CT evaluation with congenital pulmonary veins abnormalities in neonates and infants. Radiographics 2012; 32(1): 87-98
-