Maladie d'Ebstein

Radiographie standard :
Variable, parfois normale, classiquement cardiomégalie en « ballon de rugby » ou « boite » posée sur le diaphragme avec une disparition de l’arc moyen gauche, des hiles grêles et une faible vascularisation pulmonaire
Définition et épidémiologie
Décrite pour la première fois en 1866 par Wilhelm Ebstein, cette anomalie reste rare, elle représente moins de 1% des cardiopathies congénitales[1,2,3].
Elle est définie par une valve tricuspide ayant une implantation septale anormalement apicale. Il en resulte une "atrialisation" d'une partie du VD.
Embryologie
Les bourgeons endocardiques du canal atrioventriculaire forment les valves atrioventriculaires par diverticulisation. La maladie d’Ebstein est due à une anomalie de cette diverticulisation
Description anatomique et variantes
On constate:
- une adhérence des valves septale et postérieure de la tricuspide au plan sus-jacent, qui entraine un déplacement apical de l’anneau tricuspide et une atrialisation d’une partie du ventricule droit.
- des fenestrations et attaches de la valve antérieure anormales, la rendant peu mobile
- une dilatation de l’anneau tricuspide
- habituellement, des anomalies de la paroi du ventricule droit.
C’est en fait une véritable maladie du cœur droit[1].
Le spectre de cette malformation est étendu et répond essentiellement à une classification anatomo-chirurgicale de gravité croissante, qui a pour but de faciliter le choix de la technique chirurgicale la plus appropriée.
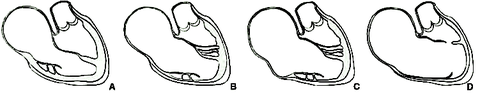
Classification de Carpentier :[3, 6]
- Type A : Petite chambre atrialisée contractile avec une valve antérieure large et mobile, bon volume ventriculaire
- Type B : Déplacement important des valves septale et postérieure, large chambre atrialisée de contractilité normale ou non avec une valve antérieure de mouvement diminué, petit ventricule droit
- Type C : Mouvements réduits de la valve antérieure qui se présente comme un reliquat fibreux, commissures bien délimitées, orifice tricuspide sténosé avec des valve septale et postérieure hypoplasiques, ventricule droit très réduit et chambre atrialisée large et non contractile, parfois anévrysmale. On peut trouver des bandes musculaires atriales qui rejoignent la paroi ventriculaire responsable de troubles de la conduction.
- Type D : « sac tricuspide », les valves sont adhérentes à la paroi ventriculaire, la chambre atrialisée difficilement identifiable, la paroi du ventricule fine peu contractile.
Cette malformation est souvent associée à d’autres anomalies cardiaques : [2]
- CIA ou foramen ovale perméable (80% des cas) : diminue la charge de l’oreillette droite et entraine un shunt droit-gauche responsable de la cyanose.
- Atrésie ou sténose pulmonaire, expliquée par un manque de développement de la voie de sortie droite par manque de débit durant l’organogénèse.
- CIV, coarctation de l’aorte.
- Canal artériel persistant ; en effet il s’agit d’une pathologie ductodépendante dans les formes néonatales, le flux pulmonaire étant réduit.
Clinique et évolution à long terme
La classification rend compte de la variabilité de cette malformation qui est responsable d’un spectre clinique étendu.
Ainsi certaines formes gravissimes ne sont même pas viables et une mort in utero est observée alors que dans des formes mineures, le diagnostic peut être posé par hasard ou tard dans la vie adulte.
L’évolution dépend essentiellement du délai d’apparition des signes cliniques ( cyanose, …) qui est largement dépendante du type de la classification de Carpentier.
Celermajer a montré une bonne corrélation entre le ratio: surface comprenant l’oreillette droite et de la chambre atrialisée/ surface fonctionnelle du ventricule droit + surface de l’oreillette gauche et ventricule gauche et le taux de survie de nouveaux nés à court et long terme. Ce ratio est mesuré en échocardiographie sur la coupe 4 cavités en télédiastole. Cette classification simple permet d’avoir une meilleure approche pronostique pour ces nouveaux-nés.
L’autre élément essentiel influençant le pronostic indépendamment de la sévérité de la maladie d’Ebstein est la présence d’autres anomalies cardiaques.
On remarque cependant que les formes néonatales sont dominées par la cyanose, les formes du nourrisson par une insuffisance cardiaque, les formes infantiles par un souffle cardiaque, alors que chez les adultes l’arrythmie sera la principale manifestation.
Il existe un réel risque de mort subite par arrythmie, peu prévisible, estimé à 3 à 10% [1].
La survie des nouveaux-nés est estimée à 67% à un an et à 59% à 10 ans. [4]
Environ 40% des patients sont opérés, avec un taux de mortalité peropératoire élevé, de l’ordre de 10%.
Traitement
Plusieurs techniques chirurgicales ont été développées avec de plus ou moins bons résultats.
La capacité du ventricule droit à recevoir une charge supplémentaire doit guider la technique chirurgicale, on comprend ainsi l’intérêt de la classification de Carpentier.
On distingue les techniques palliatives, conservatrices et non conservatrices. [3, 4 ]
Les techniques palliatives
Elles correspondent au traitement chirurgical d'une atrésie tricuspide.
Les techniques conservatrices
L’intervention de Hunter-Lillehei-Hardy est aujourd’hui abandonnée, au profit de la technique de Danielson ou de Carpentier.
L’intervention de Danielson consiste en une plicature transversale de la chambre atrialisée ramenant les feuillets valvulaires au niveau de l’anneau tricuspide, associée à une annulosplastie avec la valve antérieure, réalisant une valve monocuspide.
L’intervention de Carpentier, aujourd’hui la plus pratiquée, consiste en une plicature longitudinale de la chambre atrialisée avec une mobilisation de la valve antérieure et postérieure qui sont replacées sur l’anneau.
Les techniques non conservatrices
Il s’agit alors d’un remplacement valvulaire tricuspide par une valve porcine ou mécanique. La valve porcine est préférée en raison du faible risque thromboembolique.
Imagerie
Préopératoire
On peut détecter une maladie d’Ebstein sur un scanner cardiaque mais en pratique celui-ci n ‘a aucun intérêt, il n’est donc pas réalisé en pré opératoire.
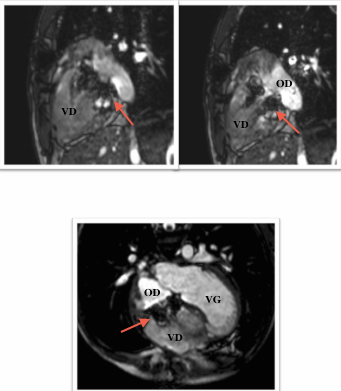
L’examen de référence reste l’échographie mais l’IRM permet également un diagnostic et une stadification précise de l’anomalie, d’autant plus qu’il s’agit d’une anomalie du cœur droit et qu’on sait aujourd’hui à quel point l’IRM est un outil précieux pour évaluer la fonction ventriculaire droite, information indispensable pour déterminer le geste chirurgical le plus approprié.
Choi YH [7], déjà en 1994, montre l’intérêt de l’IRM qui permet une analyse morphologique et fonctionnelle précise.
Les coupes morphologiques axiales montrent parfaitement la forme caractéristique du cœur dans cette anomalie avec une rotation antihoraire, un bombement du ventricule gauche vers l’arrière et une déviation vers l’arrière de l’axe du septum inter ventriculaire. On visualise également l’anomalie d’implantation des feuillets antérieurs et septaux sur les coupes axiales, alors que des coupes coronales obliques permettent une étude du feuillet postérieur, une meilleure mesure des dimensions de l’oreillette et de la chambre atrialisée.
Il faut également s’attacher à une bonne visualisation de l’infundibulum afin, notamment dans les formes néonatales, de ne pas méconnaitre une sténose voire une atrésie pulmonaire associée.
Le défect inter-auriculaire est quant à lui bien identifié sur les coupes 4 cavités ou axiales simples.
Les séquences obliques SSFP ciné sont réalisées pour évaluer le degré de régurgitation de la valve tricuspide, et ne pas passer à coté d’un défect inter auriculaire ou d’une sténose pulmonaire.
Une étude récente [8]montre une bonne corrélation entre les données IRM et échographiques, notamment sur la mesure du volume de la chambre atrialisée, de l’oreillette droite et du ventricule droit en télédiastole sur les séquences 4 cavités permettant de calculer l’index décrit par Celermajer en échographie. Elle note également que les coupes axiales permettent des mesures des volumes plus fiables que les coupes petit axe.
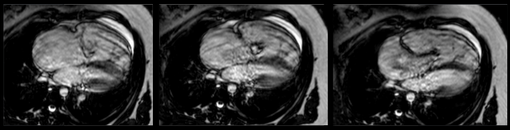
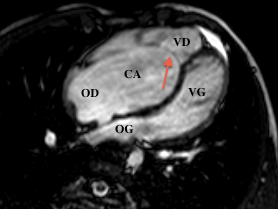
Postopératoire
En post opératoire, le scanner peut être fortement utile pour détecter des complications à type de fistules artério-veineuses ou veino-veineuses, ainsi que d’éventuelles sténoses anastomotiques en cas d’intervention de Fontan, de Glenn ou cavo-pulmonaire totale
Le principal objectif est de déterminer la fonction ventriculaire droite, de détecter et d’évaluer une éventuelle fuite résiduelle ou une sténose tricuspide dans le cas des techniques correctrices.
Dans le cas des dérivations cavopulmonaires ou de Fontan, la recherche de sténose anastomotique, de fistules artérioveineuses est importante, de même que la visualisation d’un éventuel thrombus. Les séquences d’angioIRM sont donc indispensables
Bibliographie
- François, Lethor JP, Worms AM. Maladie d'Ebstein.EMC Cardiologie, 1998 ; [11-040-E-10]
- Kastler B, Clair C, Livolsi A, Narboux Y, Delabrousse E, Sarliève P et al. Malformations des artères pulmonaires. Cardiopathies cyanogènes : aspects IRM.EMC Radiodiagnostic, 2002 ; [ 32-015-F-70]
- Carpentier A, Chauvaud S, Mac L et al A new reconstructive operation for Ebstein’s anomaly of the tricuspid valve. J Thorac Cardiovasc Surg 1988:96:92-101
- Celermajer DS, Bull C, Till JA., Cullen S, Vasillikos VP, Sullivan ID et al. Ebstein’s anomaly: Presentation and Outcome From Fetus to Adult. Jam Coll Cardiol 1994 : 23:170-176
- Celermajer DS, Cullen S, Sullivan ID, Spiegelhalter DJ, Wyse RK, Deanfield JE. Outcome in neonates with Ebstein’s anomaly. J Am Coll Cardiol 1992; 19:1041–1046.
- Chavaud.S. Anomalie d’Ebstein : techniques chirurgicales, valvulaires et ventriculaires. EMC Techniques chirurgicales-Thorax, 2008,42-841
- Choi YH, Park JH, Choe YH, Yoo SJ. Imaging of Ebstein’s anomaly of the tricuspid valve. AJR Am J Roentgenol 1994; 163:539–543.
- Yalonetsky S, Tobler D, Greutmann M, Crean AM, Wintersperger BJ, Nguyen ET, Oechslin EN, Silversides CK, Wald RM. Cardiac Magnetic Resonance Imaging and the Assessment of Ebstein Anomaly in Adults, Am J Cardiol, 2011 ; 107 : 767-773