Transposition corrigée des gros vaisseaux
Définition et épidémiologie
C’est une anomalie rarissime puisqu’elle représente environ 0,05% des cardiopathies congénitales, et survient dans 1/ 33000 naissances.[1]
Elle est définie par l’association d’une discordance atrioventriculaire et ventriculoartérielle.
Embryologie
L’origine embryologique n’est pas élucidée à ce jour.
Au cours de l’embryogenèse, le tube cardiaque primitif subit une plicature, le « looping bulboventriculaire », le tube s’infléchissant vers la droite, D-loop, et le canal atrioventriculaire se situe en amont du coté gauche du ventricule primitif. On suppose qu’en cas de looping gauche ou L-loop, ce soit alors la partie droite du ventricule primitif qui se retrouve en face du canal atrioventriculaire, et dans l’évolution cette partie deviendra le ventricule droit en relation avec l’oreillette gauche et le ventricule gauche en relation avec l’oreillette droite. La latéralisation des structures cardiaques est très précoce, et est déterminée avant toute asymétrie visible macroscopiquement.
Anatomie descriptive et variantes
Les oreillettes ont une disposition et une morphologie normales mais l’oreillette droite est en connexion avec le ventricule gauche par une valve de morphologie mitrale, et l’oreillette gauche est en connexion avec un ventricule morphologiquement droite avec une valve tricuspide.
En aval, le ventricule morphologiquement droit est relié à l’aorte qui apparaît antérieure et gauche dans la majorité des cas, et le ventricule morphologiquement droit relié au tronc de l’artère pulmonaire.
Il existe alors une anomalie du septum interauriculaire en raison de l’inversion des valves atrioventriculaires et une continuité mitro-pulmonaire. L’anomalie du septum entraine un déplacement du sinus nodal, pouvant conduire à des anomalies de la conduction.
Les artères coronaires ont la morphologie de leur ventricule. Ainsi, l’artère coronaire suivant le ventricule morphologiquement droit aura l’anatomie d’une coronaire droite et inversement. Les variantes des coronaires ne sont pas exceptionnelles.
Les anomalies associées, qui sont quasi systématiques, sont représentées par :
- une communication interventriculaire
- une sténose de la voie pulmonaire
- une anomalie de la valve tricuspide
- une anomalie de la conduction atrioventriculaire
Clinique
La présentation clinique est plus liée aux anomalies cardiaques associées qu’à l‘anomalie morphologique en elle-même.
- En cas de sténose pulmonaire avec CIV, les manifestations cliniques seront précoces par la cyanose et un souffle éjectionnel.
- En cas de CIV isolée, les symptômes surviendront plus tard dans la vie par des signes d’insuffisance cardiaque.
- Dans les cas isolés, sans autre anomalie cardiaque, les patients peuvent rester asymptomatiques tout au long de leur vie, mais souvent ils développent des anomalies de la conduction ou des signes d’insuffisance cardiaque, le ventricule droit n’ayant pas les caractéristiques morphologiques pour assurer un débit systémique durant plusieurs décennies.
- Environ 1/3 des patients naissent avec un BAV et il existe 2% par an de risque en moyenne de développer un BAV .
Traitement
Initialement, seule une réparation physiologique, c’est à dire des anomalies cardiaques associées était réalisée.
De nos jours, une réparation anatomique est associée, c’est à dire que le ventricule morphologiquement gauche retrouve son rôle de ventricule systémique.
Les indications et les techniques chirurgicales diffèrent selon le type, l’âge et la présentation clinique du patient.
Pour cela, il est effectué soit la technique du double switch (atrial et artériel) soit un switch atrial associé à l’intervention de Rastelli.
En cas de sténose pulmonaire et CIV, un switch à l’étage atrial est réalisé associé à une intervention de Rastelli, avec dérivation par un conduit au travers de la CIV de l’aorte et mise en place d’un tube VD-AP pour traiter la sténose pulmonaire.
Dans les autres cas, le switch atrial sera associé à un switch artériel.
Parfois, un cerclage de l’artère pulmonaire est effectué avant l’intervention pour augmenter la force de contractilité du ventricule morphologiquement gauche et que ce dernier puisse assurer sa fonction de ventricule systémique une fois l’intervention réalisée[2]
Selon l’état de la valve tricuspide, un remplacement valvulaire peu être indiqué.
Dans de rares cas, la fonction ventriculaire est trop détériorée et seule une transplantation peut être envisagée.
Evolution à long terme
Les résultats sont bons, avec une mortalité opératoire d’environ 5% et une survie à 20 ans d’environ 80% quelque soit la technique chirurgicale[].
Le pourcentage de patients libres de réintervention est d’environ 80% chez les patients ayant eu une intervention de type switch atrial et redirection du flux systémique vers l’aorte avec ou sans conduit, et de 95% chez ceux ayant bénéficié d’un double switch atrial et artériel[].les facteurs de mauvais pronostic sont la dysfonction ventriculaire droite, la nécessité d’un entrainement préopératoire du ventricule morphologiquement gauche[].
La majeure partie des patients nécessiteront l’implantation d’un pacemaker au cours de leur vie.
Imagerie
Pré-operatoire
Que ce soit le scanner ou l’IRM, ces deux techniques permettent une étude anatomique précise de l’anomalie.
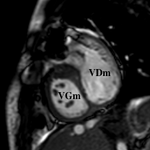
Les coupes axiales ou 4 cavités permettent de visualiser la morphologie des ventricules, avec un ventricule présentant de multiples trabéculations, une bande modératrice, relié à l’aorte et à l’oreillette gauche, et localisé à gauche du thorax.
L’aorte est visualisée en avant et à gauche de l’artère pulmonaire, dans la majorité des cas.
L’analyse doit comprendre : la recherche d’une sténose de la voie pulmonaire, d’évaluer la taille des artères pulmonaires, la détection d’une CIV ou d’une anomalie de naissance ou de trajet des coronaires.
Dans le cadre de l’IRM, l’étude des fonctions ventriculaires est indispensable.
GALERIE D'IMAGES:
Post-opératoire
L’IRM est l’examen de choix dans le suivi de ces patients.
Elle permet une analyse précise des chenaux cave et pulmonaire, ainsi que la visualisation d’une éventuelle sténose à leur niveau. Le chenal pulmonaire passe en arrière de l’oreillette gauche pour rejoindre l’oreillette morphologiquement droite en contournant la veine cave supérieure. Les deux veines caves, quant elles, suivent un chenal qui rejoint le ventricule morphologiquement droit.
L’analyse des fonctions ventricules est aisé ainsi que l’analyse des voies de sortie droite et gauche à la recherche d’une sténose aortique (surtout en cas de conduit au travers d’une CIV), une sténose pulmonaire ou une insuffisance aortique (surtout en cas de switch artériel). Une éventuelle fuite tricuspidienne doit également être décrite.
Le scanner peut être indiqué, notamment lorsqu’on suspecte une sténose coronarienne. Il est néanmoins moins précis pour l’analyse des chenaux atriaux car des artefacts liés au produit de contraste dans la veine cave supérieure rendent souvent difficile l’interprétation.
GALERIE D'IMAGES:
Bibliographie
- Wallis GA, Debich-Spicer D, Anderson RH. Congenitally corrected transposition. Orphanet Journal of Rare Diseases. 2011 ;6 :22
- Brawn WJ.The double switch for atrioventricular discordance. Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann. 2005 ; 8 :51-56
- Lim HG, Lee JR, Kim YJ, Park YH, Jun TG, Kim WH, Lee CH, Park HK, Yang JH, Park CS, Kwak JG. Outcomes of biventricular repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 2010 ; 89 : 159-167
- Hiramatsu T, Matsumura G, Konuma T, Yamazaki K, Kurosawa H, Imai Y. Long-term prongnosis of double-switch for congenitally corrected transposition of the great arteries. Eur J of Card Thorac Surg. 2012 ; 0 : 1-5
- Schmidt M, Theissen P, Deutsch HJ, Dederichs B, Franzen D, Erdmann E, Schicha H. Congenitally corrected transposition of the great arteries( L-TGA) with situs inversus totalis in adulhood : finding with magnetic resonance imaging. Magnetic Resonance Imaging. 2000 ; 18 : 417-422
- Lembcke A, Koch C, Dohmen PM, Rutsch W, Abbara S, Krug LD, Muehler MR, Rogalla P. Electrographic-gated multislice computed tomography for visualization of cardiac morphology in congenitally corrected transposition of the great arteries. J Comput Assist Tomogr. 2005 ; 29 : 234_237
- Reddy GP, Caputo GR. Case 15 : Congenitally corrected transposition of the great arteries. Radiology. 1999 ; 213 : 102-106
- Chang DS, Barack BM, Lee MH, Lee HY. Congenitally corrected transposition of the great arteris : imaging with 16-MDCT. AJR. 2007 ; 188 : W428-W430