Atrésie tricuspide
Définition et épidémiologie
Il s’agit d’une anomalie très rare et grave, représentant environ 1% des cardiopathies congénitales, avec une prévalence de 1/ 25000 naissances environ [1, 2].
Elle est définie par l’absence de connexion entre l’oreillette droite et le ventricule droit. Classiquement, la valve tricuspide n’existe pas, elle est remplacée par un tissu musculaire, plus rarement par une membrane. Exceptionnellement, on visualise une valve imperforée. Il en résulte une hypoplasie du ventricule droit.
Le diagnostic prénatal est réalisé fréquemment, permettant une prise en charge néonatale adaptée. Dans 80% des cas, une estimation correcte du devenir post-natal est possible, avec un taux d’interruption médicale de grossesse d’environ 30%.
Embryologie
La raison pour laquelle la valve tricuspide ne se développe pas est inconnue à ce jour. Elle peut etre associé, rarement, au « cat eye syndrome », à l’asplénie ou à une microdéletion 22q11.
Description anatomique et variantes
La classification la plus utilisée est celle de Edwards et Burchell :
Type 1 : vaisseaux normoposés (70%)
-A : atrésie pulmonaire à septum intact
-B : sténose pulmonaire, CIV souvent restrictive
-C : pas de sténose sur la voie d’éjection droite
Type 2 : vaisseaux en D-transposition (30%)
-A : sténose pulmonaire
-B : pas de sténose pulmonaire, hyperdébit pulmonaire par une CIV non restrictive.
La forme la plus fréquente est le type 1B.

Au niveau des connexions ventriculoartérielles, les vaisseaux peuvent, comme le montre la classification, être normoposés ou transposés. Un ventricule gauche ou droit à double issue est aussi possible.
Les sténoses de la voie pulmonaire sont fréquentes, de la simple sténose à une véritable atrésie pulmonaire.
La communication interventriculaire peut siéger n’importe ou, voire rarement être absente.
Une veine cave supérieure gauche est présente dans 15% des cas.
Les autres variantes sont celles des anomalies associées : atrésie pulmonaire et collatérales, transpositions des gros vaisseaux et sténose aortique…
Physiopathologie
En cas de vaisseaux normoposés
En aval : hypoplasie ventriculaire droite
Selon la présence ou non d’une sténose sur la voie pulmonaire : hypovascularisation pulmonaire a retro par le canal artériel, ou hyperdebit pulmonaire par une CIV non restrictive
En amont : -hypertrophie et dilatation de l’OD : stase veineuse, hépatomégalie
-shunt droit-gauche à l’étage auriculaire responsable d’un hyperdébit systémique et d'une cyanose périphérique.
En cas de vaisseaux malposés
En aval : hypoplasie ventriculaire droite, stase veineuse et hépatomégalie
Selon la présence ou non d’une sténose pulmonaire : hypervascularistion pulmonaire ou hypovascularisation pulmonaire.
En amont : selon l’existence ou non d’une sténose aortique, il existe une gène à l’ejection du VG
Clinique
Dans les formes avec vaisseaux normoposés et sténose pulmonaire
La cyanose est constante, souvent précoce et sévère, majorée à la fermeture du canal artériel. Pas de signe d’insuffisance cardiaque. La sténose protège l’arbre pulmonaire, présence d’un souffle systolique.
Dans les formes avec transposition des gros vaisseaux
Cyanose discrète. Souffle systolique due à la CIV. Insuffisance cardiaque par augmentation du flux pulmonaire, en l’absence de sténose pulmonaire. Hépatomégalie d’autant plus importante si la CIA est restrictive.
.
L’évolution naturelle est sombre, avec jusqu’à 75% de décès dans la première année pour les formes avec hypovascularisation pulmonaire.
Traitement
Etant donné l’extrême hypoplasie du ventricule droit, le cœur est considéré comme cœur à ventricule unique fonctionnel. Le traitement chirurgical définitif consiste donc en une réparation univentriculaire.
Les techniques palliatives :
Manoeuvre de Rashkind
Il s’agit d’un cathétérisme interventionnel. L’opérateur monte une sonde munit d’un ballonnet à son extrémité distale, par voie veineuse fémorale. La sonde remonte dans l’oreillette droite puis au travers du foramen ovale dans l’oreillette gauche. Le ballonnet est alors gonflé, puis la sonde retirée, déchirant ainsi le septum inter-auriculaire et permettant d’avoir une communication inter-auriculaire (CIA) large.


Les techniques correctrices
- Anastomose cavobipulmonaire ou bidirectionnelle de Glenn: Anastomose terminolatérale entre la VCS et l’artère pulmonaire droite.

- Dérivation atrioventriculaire type Fontan: Tube prothétqieuentre l'AP et le VD associé à une anastomose de type Gleen et mise en place d'une valve prothétique au niveau de la VCI ou Fontan modifié avec anastomose entre l'AP et l'auricule droit sans tube ni valve prothétique.

- Anastomose cavopulmonaire totale:
Soit par un chenal intra-auriculaire droit entre la VCS et le VCI soit par un tube extracardiaque entre la VCI et l'APD.

- En cas de variantes anatomiques:
Types d’intervention de dérivation cavo-pulmonaire en cas de variantes anatomiques : double veine cave supérieure ou continuation azygos (intervention de Kawashima)

Evolution à long terme
Traitement définitif.
Moins de 10% des patients décèdent avant une intervention palliative ; et environ 25% après une intervention palliative.
A cela, s’ajoute les patients chez qui l’intervention de Fontan est contre-indiquée.
Au total, seulement 50% des patients seront candidats à une intervention correctrice. Des critères de sélection bien précis sont définis ( préssion artérielle pulmonaire, taille des artères pulmonaires, fonction ventriculaire…).
Le taux de survie globale est estimé à 90% à un mois, 81% à 1 an, 70% à 10 ans et 60% à 20 ans.[]
Le taux de survie des patients chez qui une intervention de Fontan a été effectuée est de 79% avec un suivi médian de 13 ans.[]
La mortalité peropératoire est faible de nos jours, de 2% environ.
Les complications décrites sont principalement : les dysrythmies, la survenue d’une entéropathie exsudative, l’insuffisance cardiaque, des problèmes thrombo-emboliques.
Ces complications ne sont pas retrouvées dans la majorité des cas et les patients survivent dans de bonnes conditions de vie ( 89% dans la classe I du NYHA).
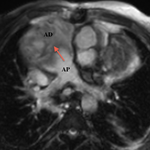
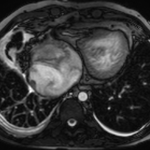
Imagerie
Préopératoire
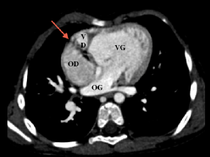
L’échographie fait parfaitement le diagnostic, et le cathéterisme est indispensable pour la mesure des pressions pulmonaires; l’imagerie en coupes n’a pas de place ici à moins que l’échographie ne soit pas contributive, chose exceptionnelle.
Parfois, un scanner peut être réalisé surtout pour évaluer l’anatomie des artères pulmonaires, la présence de voies collatérales aorto-pulmonaires en cas d’atrésie pulmonaire ou l’analyse de l’anatomie des coronaires en cas de transposition des gros vaisseaux associée.
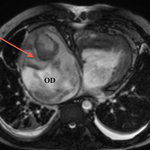
Postopératoire
- Apres intervention palliative, type Blalock-Taussig
un scanner peut etre demandé pour évaluer la perméabilité du shunt ou une sténose anastomotique.
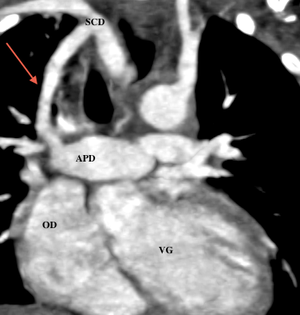
- En post-opératoire d’une intervention de Glenn
Le scanner et l’IRM sont très intéressants pour évaluer l’anatomie des artères pulmonaires et dans le cas de l’IRM pour l’étude de la fonction ventriculaire droite, pour orienter vers la possibilité ou non d’une totalisation de la dérivation cavo-pulmonaire. Etant donné qu’un cathétérisme cardiaque est obligatoire pour évaluer les resistances vasculaires pulmonaires, l’IRM n’est pas forcement réalisée ; mais une étude récente montre que chez certains patients et selon des critères bien précis, l’IRM pourrait être suffisante .
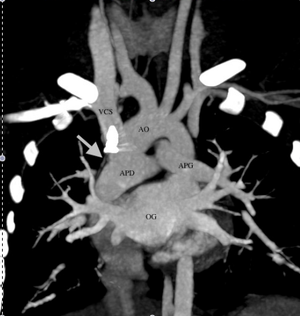
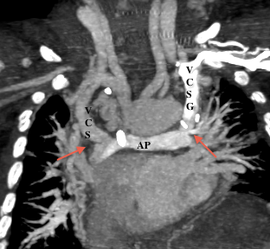
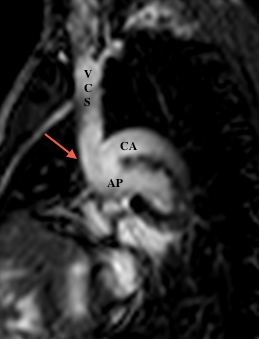
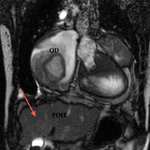
- En post-opératoire d’une intervention de Fontan
L’IRM est préférée au scanner, permettant une analyse des anastomoses réalisées, de leur aspect et leur pérméabilité.
Il faut également rechercher des complications :
- Thromboses intraauriculaire, du conduit VCS- AP, embolie pulmonaire
- Dilatation de l’oreillette droite ou du conduit entre la VCS et les artères pulmonaires.
- Malformations artérioveineuses pulmonaires entre veines bronchiques et pulmonaires voir entre oreillette gauche et veines bronchiques
- Collarérales aorto-pulmonaires
- Dilatation de la VCI et des veines sus-hépatiques avec développement possible d’une cirrhose hépatique, l’aspect du foie est donc important à décrire.
- L’évaluation de la fonction du ventricule unique
- La présence d’anomalie bornchique, pouvant etre à l’origine d’atéléctasie( moules bronchiques ou plastic bronchitis pour les anglophones).
- La présence ou non d’insufisance valvulaire mitrale
- Epanchement pleural, péricardique ou chylothorax[5].
GALERIE D'IMAGES:
Bibliographie
- Brevière GM, Rey C. Atrésie tricuspide. EMC cardiologie. 2000 ; 11-041-M-10
- Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax.1971; 26:240–248
- Mochizuki T, Ohtani T, Higashino H, Sugawara Y, Tsuda T, Sekiya M, Miyagawa M, Ohmoto K, Ikezoe J. Tricuspid Atresia With Atrial Septal Defect, Ventricular Septal Defect, and Right Ventricular Hypoplasia Demonstrated by Multidetector Computed Tomography.Circulation. 2000;102:e164-e165.
- Prabhu SP, Mahmood S, Sena L, Lee EY. MDCT evaluation of pulmonary embolism in children and young adults following a lateral tunnel Fontan procedure: optimizing contrast-enhancement techniques. Pediatr Radiol (2009) 39:938–944
- Fredenburg TB, Johnson TR, Cohen MD. The Fontan Procedure: Anatomy, Complications, and Manifestations of Failure. RadioGraphics 2011; 31:453–463
- Berg C, Lachmann R, Kaiser C, Kozlowski P, Stressig R, Schneider M, Asfour B, Herberg U, Breuer J, Gembruch U, Geipel A. Prenatal diagnosis of tricuspid atresia: intrauterine course and outcome. Ultrasound Obstet Gynecol 2010; 35: 183–190
- Ait-Ali L, De Marchi D, Lombardi M, Scebba L, Picano E, Murzi B, Festa P. The role of cardiovascular magnetic resonance in candidates for Fontan operation: Proposal of a new Algorithm. Journal of Cardiovascular Magnetic Resonance 2011, 13:69