Anomalies congénitales des coronaires
Définition et épidémiologie
Dans la population générale, les anomalies congénitales sont rares, estimées à environ 1% dans la population pédiatrique[1]. Néanmoins, ce chiffre augmente en cas de cardiopathies congénitales .Par exemple, dans 25% des cas, la tétralogie de Fallot est associée à une anomalie de naissance des coronaires.
Embryologie
Les coronaires sont issues de sinusoïdes développées au sein de l’épicarde, s’insinuant dans le myocarde, puis qui confluent pour donner les artères coronaires qui viennent s’aboucher au niveau des sinus du même nom. Il ne s’agit pas d’une excroissance artérielle au niveau des sinus coronaires, comme cela a été décrit initialement[2].
Anatomie descriptive et variantes
Rappel d'anatomie
Les artères coronaires sont au nombre de deux, l’artère coronaire droite nait du sinus coronaire droit, et l’artère coronaire gauche nait du sinus coronaire gauche.
L’artère coronaire droite (CD) chemine ensuite le long de la jonction atrio-ventriculaire droite pour rejoindre le sillon interventriculaire postérieure où elle donne l’artère interventriculaire postérieure et l’artère rétro-ventriculaire.
L’artère coronaire gauche (CG) se divise très vite en une artère interventriculaire antérieure et une artère circonflexe, qui chemine dans le sillon atrio-ventriculaire gauche. L’artère circonflexe donne naissance à une ou plusieurs artères marginales, qui cheminent sur la face antérieure du ventricule gauche. L’artère interventriculaire antérieure donne naissance aux artères diagonales sur la face antérieure du VG[3].
Les anomalies rencontrées
Anomalies d’origine sinusale :
- Origine haute (au dessus de 1 cm des sinus de Valsalva)
- Artère coronaire droite naissant du sinus coronaire gauche
- Artère coronaire gauche naissant du sinus coronaire droit
- Artère circonflexe naissant du sinus coronaire droit
- Artère interventriculaire antérieure naissant du sinus coronaire droit
Origine ectopique :
- Du tronc de l’artère pulmonaire
- De l’artère pulmonaire droite
- De l’artère pulmonaire gauche
- Du tronc artériel brachio-céphalique
Anomalie de trajet :
- pont myocardique
- Interartériel
- Prépulmonaire
- Intramural
- septal ou subpulmonaire
Artère coronaire unique :
- Droite
- Gauche
Connections fistuleuses anormales :
- Avec une cavité cardiaque
- Fistule coronaire artério-veineuse
- Fistule avec une veine ou une artère extracardiaque
Duplication coronaire
Variantes en fonction des cardiopathies
C’est surtout dans le cadre de certaines cardiopathies complexes qu’on retrouve des anomalies assez commune, importante à connaître.
Dans la tétralogie de Fallot
La principale anomalie à connaître est la présence d’une artère naissant de l’artère coronaire droite (interventriculaire antérieure ou conale) qui croise l’infundibulum pulmonaire ( 5% des cas). Ceci est important à connaître en préopératoire pour ne pas léser cette artère lors de l’infundibulotomie. La branche conale finira sa course sur l’infundibulum alors que l’IVA ira dans le sillon interventriculaire antérieur. Les autres anomalies sont : la présence de 2 IVA (une naissant de la CD, l’autre de la CG), un ostium coronaire gauche unique.
Dans les transpositions des gros vaisseaux
L’anomalie la plus commune est la naissance de la CD du sinus postéro-droit et la naissance de la CG du sinus postéro-gauche.
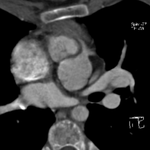
La seconde est la naissance de l’artère circonflexe de l’artère CD (image), qui a un trajet rétro-artériel. Elle ne doit pas être confondue avec une artère diagonale, l’artère du sinus nodal ou une veine.
Il faut être attentif à un éventuel trajet intramural, qui donne un aspect de double bord à la paroi postérieure de l’aorte. Une naissance supra-sinusale est vue dans 20% des cas.[4]
Dans le VDDI
Les anomalies sont similaires à celle rencontrées dans la tétralogie de Fallot lorsqu’il s’agit d’une forme Fallot-like et à celles des TGV dans les formes Taussig-Bing.
Dans le tronc artériel commun
Les origines supra-sinusales sont fréquentes, ainsi que des anomalies de trajet.
Dans les sténoses pulmonaires ou atrésie avec un septum interventriculaire intact
On constate la présence de sténose voir d’interruption des coronaires ainsi que la présence de fistules coronaro-camérales avec le ventricule droit. La forme extrême est responsable d’une vascularisation coronaire VD-dépendante.
Naissance des coronaires du tronc de l’artère pulmonaire
La plus fréquente est l’ALCAPA ( anomalous left coronary artery from the pulmonary artery), ou syndrome de Bland-White-Garland, estimé à 1/250 dans les cardiopathies congénitales et 1/300000 nouveaux nés. Plus fréquente chez le garçon, elle se manifeste par une défaillance cardiaque chez le nourrisson du fait de l’ischémie myocardique sévère[3,4].
Traitement
Il dépend surtout de la cardiopathie associée.
En cas de forme isolée, si elle est symptomatique ( mort subite récupérée ou ischémie myocardique), un traitement chirurgical peut être envisagé. Dans les formes asymptomatiques, la décision chirurgicale est beaucoup moins consensuelle.
La chirurgie consiste soit à :
- une réimplantation de l’artère coronaire ayant une naissance anormale ;
- une décompression de l’artère coronaire ayant un trajet interartériel par translocation antérieure ou latérale de l’artère pulmonaire (on résèque l’artère pulmonaire droite puis par un patch on augmente sa longueur et ainsi déplace le tronc de l’artère pulmonaire antérieurement ou on sectionne le tronc de l’AP et le réimplante plus latéralement sur l’artère pulmonaire gauche) ;
- en cas de trajet intramural, une résection de la paroi aortique pour découvrir l’artère [5].
Evolution à long terme
Dans le cadre de cardiopathies complexes, comme la tétralogie de Fallot ou la transposition des gros vaisseaux, le pronostic est plus à la cardiopathie qu’à l’anomalie des coronaires. Mais une connaissance exacte de l’anatomie coronaire en pré-opératoire diminue le risque de complications chirurgicales graves.
Dans le cadre d’anomalies isolées, on décrit des morts subites et desinfarctus du myocarde aboutissant à des cardiomyopathies dilatées. L’hypothèse physiopathologique avancée concernant les morts subites est celle d’une fibrose myocardique progressive aboutissant à des troubles électrophysiologiques, responsables de troubles du rythme. Les anomalies de naissance des coronaires sont impliquées dans environ 10% des morts subites[5].
Imagerie
Etant donné la finesse des artères coronaires, le scanner est nettement supérieur à l’IRM de nos jours, en raison de sa plus grande résolution spatiale et sa rapidité d’acquisition[6, 7].
Néanmoins, l’IRM permet de déterminer l’origine et le trajet proximal des coronaires sans injection de produit de contraste, grâce à des séquences 3D en écho de gradient balancé ultra-rapide sur l ‘ensemble du cœur. Il existe des séquences de double phase acquis sur un cycle cardiaque permettant d’analyser plus de segment des coronaires, cela sort de la pratique courante[8].
En cas de cardiopathie congénitale, la description précise de l’origine et du trajet des coronaires est indispensable en pré-opératoire.
Dans le cadre d’anomalie isolée, il faut s’attacher à reconnaître un trajet intramural en cas d’anomalie d’origine. Celui-ci sera visualisé en effectuant des reconstructions dans un plan de coupe orthogonale au trajet initial de la coronaire anormale. Un aspect ovalaire de celle-ci permet de prédire un trajet intramural alors qu’un aspect bien arrondi est en faveur d’un trajet extra-mural[9].
La relation des coronaires avec les commissures des valvules aortiques est importante à préciser. Une origine anormale traversant une commissure est un risque d’insuffisance aortique post-chirurgicale[10].
La présence de pont myocardique est également parfaitement visualisable en scanner contrairement à l’angiographie[11].
GALERIE D'IMAGES:
Bibliographie
- Hlavacek A, Loukas M, Spicer D, Anderson RH. Anomalous origin and course of the coronary arteries. Cardiology in young. 2010 ; 20(suppl 3) : 20-25
- Loukas M, Groat C, Khangura R, Owens DG, Anderson RH. The Normal and Abnormal Anatomy of the Coronary Arteries .Clinical Anatomy 2009 ; 22:114–128
- Kim SY, Seo JB, Do KH, Heo JN, Lee JS, Song JW, Choe YH, Kim TH, Yong HS, Choi SI, Song KS, Lim TH. Coronary artery anomalies: classification and ECG-gated multi-detector row CT findings with angiographic correlation. Radiographics 2006; 26: 317-334
- Walsh R, Nielsen JC, Ko HH, Sanz J, Srivastava S, Parness IA, Lytrivi ID. Imaging of congenital coronary artery anomalies Pediatr Radiol .2011 ; 41:1526–1535
- Mainwaring RD, Reddy VM, Reinhartz O, Petrossian E, MacDonald M, Nasirov T, Miyake CY, Hanley FL. Anomalous Aortic Origin of a Coronary Artery: Medium-Term Results After Surgical Repair in 50 Patients.Ann Thorac Surg 2011;92:691–7
- Young PM, Gerber TC, Williamson EE, Julsrud PR, Herfkens RJ. Cardiac Imaging: Part 2, Normal, Variant, and Anomalous Configurations of the Coronary Vasculature AJR 2011; 197:816–826
- Zeina AR, Blinder J, Sharif D, Rosenschein U, Barmeir E. Congenital coronary artery anomalies in adults: non-invasive assessment with multidetector CT.The British Journal of Radiology, 2009 ; 82(975) : 254–261.
- Uribe S, Hussain T, Valverde I, Tejos C, Irarrazaval P, Fava M, Beerbaum P. Congenital heart disease in children : Coronary MR angiography during systole and diastole with dual cardiac phase whole-heart imaging. Radiology. 2011 ; 260 : 232-240
- Miller JA, Anavekar NS, El Yaman MM, Burkhart HM, Miller AJ, Julsrud PR. Computed tomographic angiography identification of intramural segments in anomalous coronary arteries with interarterial course. Int J Cardiovasc Imaging .DOI 10.1007/s10554-011-9936-9
- Baird CW. Intraluminal 3-D CT identifies coronary osteal and commissural relationships in anomalous aortic origin of coronary arteries (letter). Ann Thorac Surg 2010; 89:1341.
- Konen E, Goitein O, Sternik L, Eshet Y, Shemesh J, Di Segni E. The prevalence and anatomical patterns of intramuscular coronary arteries: a coronary computed tomography angiographic study. J Am Coll Cardiol 2007; 49:587–593.